Storia della Cannabis e dell' Utilizzo Terapeutico Medicinale
Origini e Preistoria della Cannabis
La canapa è una pianta erbacea dal profumo caratteristico a ciclo annuale, il cui habitat originario è oggetto di annose discussioni fra gli studiosi. Sino a poco tempo fa si riteneva che fosse originaria delle zone temperate dell’Asia, e sono state di volta in volta proposte le zone montuose del Caucaso, l’area del Mar Caspio, l’Asia centrale, la Cina orientale o quella occidentale. Ultimamente, fra i botanici cinesi si sta diffondendo l’opinione che la canapa sia originaria della regione di Xinjiang, nella Cina occidentale (Wu & Raven, 2003). Tuttavia, l’antichità del rapporto dell’uomo con questa pianta e la conseguente ampia diffusione attraverso la sua coltivazione, rendono difficoltosa l’individuazione dell’origine spazio-temporale del suo utilizzo umano, e i ritrovamenti archeologici nell’area europea e del Mediterraneo portano comunque a sospettare una non esclusiva origine cinese.
Ben presto le popolazioni nomadi che abitavano la regione impararono ad utilizzare questa pianta che facilmente cresceva autoctona, riconoscendo il valore sia dei fusti, da cui potevano ricavare dell'ottima fibra, sia dei semi e delle foglie, contenenti preziosi nutrienti per l'uomo e per gli animali. Il passo per utilizzare questa pianta anche a scopo magico o religioso, riconoscendo le virtù di nutrimento spirituale, legato all'assunzione della resina che ricopre i fiori e le foglie di Canapa fu breve.
I ritrovamenti asiatici più antichi parrebbero essere localizzati in Giappone, presso i reperti della cultura Jomon; questa occupò tutto l’arcipelago giapponese durante il lungo periodo del 12000-500 a.C. e fu caratterizzata da un’economia di caccia e raccolta congiuntamente alla produzione sin dai suoi primordi di vasellame, ma con scarsa evidenza di attività agricole. L' adattabilità climatica della pianta, la semplicità della sua coltivazione, unite alla ricchezza di prodotti da essa ottenuti, lasciano ritenere che la Canapa sia stata una delle più antiche colture praticate dall'uomo. E’ stata evidenziata la presenza di piante coltivate, inclusa la canapa, nei siti di Matsugasaki e Torihama del Giappone centrale; presenza datata al 4000-3220 a.C. (Matsui & Kenehara, 2006). Una data molto più antica sarebbe stata determinata nel sito di Okinoshima, nella penisola di Boso, Giappone centrale. Questo sito era probabilmente un campo temporaneo per la pesca e sono state scavate tre unità sedimentarie. Nell’unità II erano presenti in maniera sparsa artefatti in pietra, frammenti di vasellame, palle di cenere (queste ultime risultanti probabilmente dalla bruciatura artificiale di erbe), ossa di delfini e altri reperti riconducibili a un’attività antropica. Aderenti ai frammenti di vasellame sono stati identificati in numero limitato dei macrofossili vegetali, fra cui frutti di Cannabis sativa. L’analisi al radiocarbonio di questi frutti di canapa ha rivelato una possibile datazione del 8210-8130 a.C. (Kudo et al., 2009), ed è stato ipotizzato che questa pianta venisse coltivata già durante questa fase della cultura Jomon (Okazaki et al., 2011). Tuttavia, né si può essere certi di un’attività agricola associata a questi reperti, né parrebbe chiaramente definito il livello di intenzionalità antropica della presenza di questi macrofossili di Canapa, poiché, come affermato dalla medesima equipe di Okazaki (ibid., p. 91), “L’assemblaggio macrovegetale ottenuto dai frammenti di vasellame riflette l’ambiente circostante l’insediamento umano. Si ritiene che il sedimento dell’unità II sia stato trasportato dalle regioni superiori attraverso il flusso di detriti e depositato sul piano costiero”. Altri ritrovamenti provengono da alcune culture neolitiche della Cina centro-orientale. Nell’antico erbario Pên-ts’ao Ching, compilato durante la dinastia Han nel I o II secolo d.C., ma che riporta tradizioni molto più antiche, viene riportato che la canapa cresceva selvatica “attorno al monte T’ai, ma ora è comune ovunque” (Li, 1974a). Il monte T’ai si trova nell’attuale provincia di Shangtung, nella regione più centro-orientale della Cina, e la citazione dell’erbario potrebbe indicare il fatto che quell’area fu la zona originaria della pianta, e che da li l’uomo la diffuse “ovunque” mediante la sua coltivazione.
La cultura neolitica di Yang-shao, datata dal V al III millennio a.C., si diffuse nelle provincie centro-orientali di Honan, Shhanxi e Shanxi. In alcuni vasi di terracotta sono rimaste incise le impronte di tessuti e cordami di canapa che servirono per la loro fabbricazione. La datazione al radiocarbonio di alcuni di questi oggetti venuti alla luce nel sito di Pan-p’o (vicino a Sian, nella provincia di Shanxi) è risultata essere fra il 4115 e il 3535 ± 110 a.C. (Chang, 1969). Altre impronte di tessuti di canapa sono rimaste impresse sulla terra battuta di una tomba del sito di Huan-hsien (provincia di Shanxi) appartenente alla medesima cultura Yang-shao. Un insieme cospicuo di fusi, aghi e altri strumenti rinvenuti nei diversi siti di questa cultura, evidenziano una significativa attività tessitrice, e la fibra di canapa fu probabilmente la principale materia prima per l’elaborazione di cordami e tessuti.
Anche presso la cultura neolitica Lung-shan, successiva a quella Yang-shao e datata fra il 2300 e il 1200 a.C., è stata ritrovata documentazione dell’utilizzo come fibra della canapa. Presso le culture successive dell’Età del Bronzo e del Ferro la documentazione diventa sempre più frequente, sino a produrre un’evidenza diretta in un frammento di tessuto di canapa datato alla dinastia Chou, venuto alla luce in una sepoltura della cosiddetta cultura Chou (a Zhou) Occidentale (1046-771 a.C.) nella provincia di Shanxi (Ko, 1972).
Alla cultura Chou Orientale (770-221 a.C.) appartengono centinaia di reperti chiamati “documenti di giuramento”, che sono lastre di giada o di pietra con dipinte sopra delle iscrizioni rosse, scoperte nella provincia di Shanxi. Fra le iscrizioni appare il carattere ma, che significa “canapa”, in un contesto di accezione “negativa”, che nell’antica Cina era un seconda aggettivazione attribuibile all’effetto stupefacente della pianta (dove il concetto “negativo” non era corrispondente a quello che diamo oggigiorno noi occidentali) (T’ao & Wang, 1972). Ciò è una testimonianza della conoscenza degli effetti psicoattivi della canapa, e che questa non era quindi utilizzata solo per la sua fibra.
Un interessante ritrovamento è stato effettuato nel corso degli scavi delle tombe di Yanghai, situate in una regione desertica dello Xinjiang, nella Cina occidentale. In una di queste tombe (Stanza 90 tomba n. 1), che conteneva il corpo di un uomo di una quarantina d’anni d’età e di struttura fisica caucasoide, fra il corredo funebre sono stati ritrovati un cesto e una scodella di legno che contenevano un ammasso vegetale costituito da frutti, foglie e steli di Cannabis. L’analisi con il metodo del radiocarbonio ha fornito la data del 500 a.C. L’ambiente fortemente arido ha permesso una conservazione del materiale vegetale alquanto eccezionale, dove si sono potute osservare ancora in ottimo stato le strutture macroscopiche e microscopiche delle diverse parti della pianta di canapa. Nelle tombe di Xinjiang non sono stati ritrovati tessuti e fibre di canapa, un dato che evidenza una differente finalità della sua presenza nell’inumazione. La tipologia di offerte funerarie associate alla tomba di questo uomo ha suggerito il fatto che si trattasse di uno sciamano, e la funzione della canapa appare essere associato alle sue proprietà psicoattive (Jiang et al., 2006). Resti di canapa sono stati ritrovati anche in un’altra tomba del medesimo sito di Yanghai (Tomba 213, Gruppo n. 2), associata ai resti di un uomo caucasoide. In questo caso, la canapa era associata a resti di cappero (Capparis spinosa L.), entrambi contenuti nel medesimo vaso d’argilla. La datazione al C-14 è risultata essere del 620 a.C. circa (Jiang et al., 2007).
Cesto (sinistra) e scodella di legno (centro) contenenti resti di canapa (destra) in una tomba di Yanghai, Cina, 500 a.C. (da Jiang et al., 2006, fig. 2, p. 415)
Sono state trovate stoffe di canapa in un buon stato di conservazione, che ricoprivano i corpi di due inumazioni scoperte nella provincia di Kansu e appartenenti alla tarda dinastia Han Occidentale, datata fra il 100 a.C. e il 100 d.C.
A un periodo anteriore al 104 a.C. fanno parte alcuni frammenti di carta di canapa scoperti in una tomba di un sito archeologico della provincia di Shanxi, un fatto che anticipa la data dell’invenzione della carta in Cina, solitamente attribuita a Marquis Ts’ai Lun nel 105 d.C. (Pan, 1964). Ts’ai Lun inventò una carta costituita di vecchie reti da pesca – a quei tempi fatte di canapa –, vestiti logori (anch’essi di canapa), fibre di canapa e corteccia d’albero. In realtà si trattava, non tanto dell’invenzione della carta, bensì di un perfezionamento di un’invenzione – la carta a base di canapa – vecchia oramai di due secoli (per una discussione sull’origine della carta, inclusa quella costituita di canapa, si veda Drège, 1987).
In una tomba della dinastia Han, datata al 100 a.C. e ritrovata a Changsha, nella provincia di Hunan, è stato rinvenuto il corpo di una donna e il suo corredo funebre in un eccezionale stato di conservazione, per via del particolare ambiente isolato e sigillato. Fra le offerte votive erano presenti semi di canapa accanto ad altre semenze, che venivano usate a quei tempi come fonte alimentare.
Nei testi cinesi antichi era presente un vocabolario differenziato per indicare la pianta della canapa, che aveva come termine generico ma, rappresentato da un ideogramma che denotava le sue qualità come pianta da fibra, in quanto vi erano raffigurate due fibre appese a uno stenditoio e poste sotto una tettoia.
Evoluzione dell’ideogramma cinese “ma”, che significa “canapa”. A sinistra il primitivo ideogramma nella scrittura chuan; al centro nella scrittura chieh; a destra nella scrittura hsing (da Li, 1974b, fig. 1, p. 295)
Il genere e le diverse parti della pianta erano così denominate: la pianta maschio i, si o hsi, quella femminile chü o tsu, i frutti fên, pên o bên, i fiori ma p’o, i semi ma-tzu o ma-jên.
Con il
sopraggiungere delle coltivazioni di ulteriori piante da fibra, il termine ma assunse gradualmente il significato di fibra vegetale generica. In tal modo, la Boehmeria nivea (L.)
Gaudich assunse il nome cinese di chi-ma, la Urtica thunbergiana Siebold & Zucc. prese il nome di ching-ma (entrambe queste piante appartengono alla famiglia delle
Urticaceae), e l’Abutilon niveum Grisebe, della famiglia delle Malvaceae, presi il nome di chung-ma, mentre la pianta della canapa assunse i nuovi nomi di Han-ma (“ma
cinese”) e hou-ma (“ma di fuoco”) (Li, 1974a, p. 46).
La parola ma è stata usata come radicale per formare altre parole, quali mo (“demone”), equivalente a ma + “diavolo”, ed è stata associata ad altri ideogrammi per formare nuove parole, come nel caso di ma-tsui, “narcotico”, derivante dall’associazione dell’ideogramma ma con tsui (“ubriachezza”), e di ma-p’i, “paralisi”, derivante dall’associazione di ma con p’i, “reumatismo”.
Nel già
citato Pên-ts’ao Ching, che riporta tradizioni di antica data, forse raggiungenti il 2000 a.C., viene riferito che “i ma-fên (i frutti di canapa) se presi in eccesso faranno vedere i diavoli. Se presi per molto tempo, fanno comunicare con gli spiriti e illuminare il
corpo”.
Nello scritto dinastico Hou Han shu, datato al II secolo d.C., viene riferita la notizia che un famoso medico, di nome Hua T’o, usava un decotto di canapa chiamato ma-fei-san (“composto bollito di canapa”) preso con del vino, per anestetizzare i pazienti prima di sottoporli ad operazioni chirurgiche dell’addome.
Lo stesso termine anestesia (Ma-zuì) 麻醉 simile sia in cinese che in giapponese (masuì) è formato
dai due ideogrammi “ma” (canapa) 麻 e zuì (intossicazione, intorpidimento) 醉.
Illustrazione della pianta della canapa e relativa descrizione dei suoi impieghi come medicinale nell’erbario cinese Chêng-lei pên-ts’ao del X secolo d.C.
I testi sacri indiani, i libri dei “Veda” (Sapienza), compilati tra il XIV ed il X secolo a.C. parlano di una sostanza chiamata “soma”, sacra a Shiva, utilizzata in diversi tipi di cerimonie religiose, mistico-meditative e medicamentose; gli effetti descritti di espansione delle percezioni e rilassamento generale, lasciano ragionevolmente supporre che si trattasse proprio di canapa. In particolare nell’AtharvaVeda la pianta viene indicata per “liberare dall’ansia”. Alcuni scritti sanscriti farebbero risalire la canapa ad origine mitologica. Secondo la leggenda Indra, re degli déi, provando pietà per il popolo degli umani, gli regalò una bevanda a base di cannabis cosicché anch’essi potessero sperimentare le sue virtù: euforia, ampliamento delle percezioni, perdita della paura ed eccitazione sessuale.
Contestualmente l’utilizzo della prodigiosa “erba” diviene abituale nel Bihar, in Nepal e Pakistan e più a nord in Mongolia e Tibet; così come si estende dall’Egitto verso sud, diventando un medicamento essenziale contro crampi, epilessia e gotta per Pigmei, Zulu ed Ottentotti.
In Africa la cultura della cannabis si è conservata sino a tempi molto recenti, e comunque non verrà mai completamente eradicata. Nel 1888 l’archeologo Herman von Wissman (1853-1905) in una relazione sugli usi e costumi presso le tribù Baluba e Bantu del Congo belga, descrive come riti, feste e trattati di alleanza fossero regolarmente celebrati fumando hashish e foglie di canapa secche in pubblico.
Prove dell'utilizzo della cannabis si hanno fin dai tempi del Neolitico anche in Europa, testimoniate dal ritrovamento di alcuni semi fossilizzati in una grotta in Romania. [Rudgley, Richard (1999). in Touchstone: The Lost Civilizations of the Stone Age.]
Si ricorda che nella definizione di periodo neolitico si comprende l'ultimo periodo dell'età della pietra, in cui l'uomo comincia le prime coltivazioni di piante e allevamento di animali.
Il più antico manufatto umano ritrovato è un pezzo di stoffa di canapa risalente all'8000 a.C. (Small and Marcus, 2002 Small E., Marcus D., ”Hemp: A New Crop with New Uses for North America” in 2002 ).
La Cannabis è una pianta che accompagna l'uomo da circa 5000 anni ed è riconosciuta per i suoi numerosi utilizzi (ElSohly, 2005).
La importanza nella vita quotidiana dei suoi prodotti favorì una rapida espansione dell' utilizzo della tradizione della Cannabis dalle zone di origine, principalmente verso il Medioriente, la Cina orientale, e l'India, attraverso le migrazioni dei popoli e i primi scambi commerciali. John L. Sorenson e Carl L. Johannesse,World Trade and Biological Exchanges Before 1492, Universe, Bloomington, 2009, p. 151.
Inizia così il lungo viaggio della Canapa accompagnando l'Uomo alla conquista dell'intero pianeta.
La Diffusione della Canapa: Dispersione Primaria secondaria e terziaria
Tradizionalmente vengono descritti diversi momenti successivi della diffusione della canapa nel pianeta, definiti “Dispersione”.
Alla dispersione primaria, collocabile tra il 10000 ac e l’Era Pre-Cristiana seguì una dispersione secondaria durante tutto il Periodo Storico tra la nascita di Cristo fino al 1945. Nell'era moderna sta avvenendo una dispersione terziaria della specie.
Dispersione Primaria 10.000 ac - 500 ac
Dispersione Secondaria 500 ac - 1945
Dispersione Terziaria 1945 -2016
Le successive dispersioni possono ulteriormente essere suddivise, storicamente, in fasi diverse.
Riconosciamo quindi:
Dispersione Primaria
fase I: ca 10000 ac - 2000 ac (dispersione euroasiatica)
fase II: 2000 ac - 500 ac (dispersione africa e sudest-asiatica)
Dispersione Secondaria
fase III a: 500ac - 1545 (era cristiana e medioevo)
fase III b: 1545 - 1800 (il nuovo mondo)
fase IV: 1800 - 1945
Dispersione Terziaria
fase V: 1945-1990 (l'espansione nel dopoguerra)
fase VI: 1990-2016 (la situazione attuale)
Fase I della dispersione primaria
In questo periodo, databile circa tra il 10.000 ac e il 2000 ac si realizza la prima diffusione della genetica della Cannabis da i luoghi originari, zone di microclima favorevole, dove era riuscita a sopravvivere alle rigide temperature durante le glaciazioni del pleistocene.
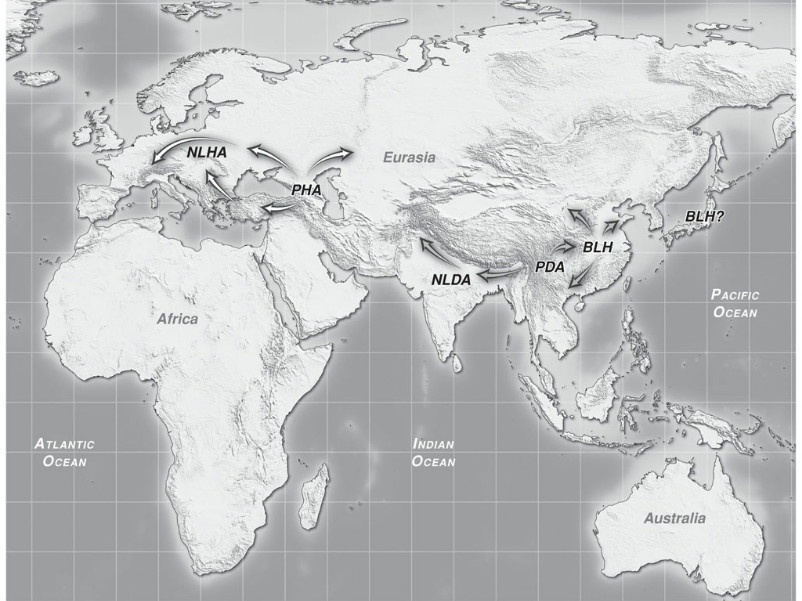
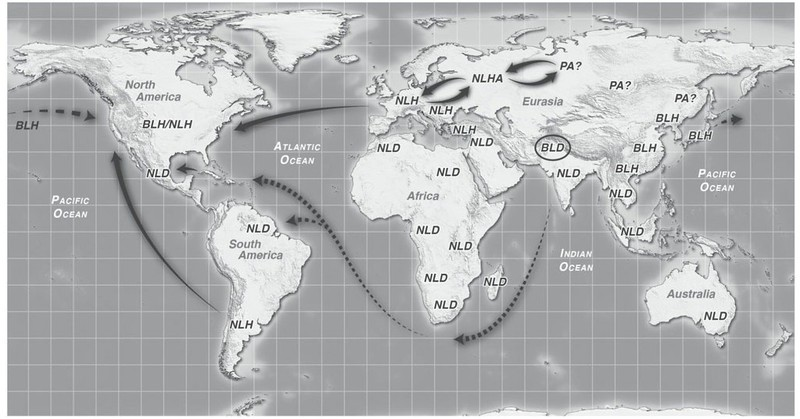
Questi luoghi, identificabili come la zona del caucaso e la cina centrale, hanno custodito la genetica delle piante che conosciamo ora. Questa versione di piante di cannabis ancestrali viene definita "antenato putativo" ed apparteneva a due tipi distinti: la varietà che ha dato origine alla pianta da fibra o PHA (putative hemp ancestor) e la varietà che ha originato le piante da droga PDA (putative drug ancestor).
Da queste zone rifugio, mentre i ghiacci si ritiravano, la cannabis inizia, insieme alle popolazioni del paleolitico il suo viaggio alla conquista del pianeta, occupando inizialmente le zone centrali di asia, oriente asiatico, montagne dell Hindu Kush e il subcontinente indiano.
I PHA sono rimasti custoditi nella zona caucasica e hanno dato origine successivamente alle varietà ancestrali a foglia stretta da fibra europee (NLHA Narrow Leaf Hemp Ancestror).
I PDA, nella zona mountuosa dell' Hegduan, odierna cina centrorientale, hanno dato origine alle varietà da droga ancestrali NLDA e BLDA, diffuse prima nella zona dell'hindu kush e successivamente verso l'afganistan.
I PDA si suppone abbiano dato origine anche alle varietà cinesi da fibra a foglia ampia BLH diffuse in cina in oriente.
In questi luoghi si pensava si fossero sviluppati i quattro differenti taxa in cui viene distinta la cannabis:
1. Cannabis sativa spp. sativa o Narrow leaf hemp NLH
2. Cannabis Indica spp. sativa o Narrow leaf drug NLD
3. Cannabis Indica spp. Afghanica o Broad leaf Drug BLD
4. Cannabis Indica spp. Chinisnsis o Broad leaf hemp BLH
Dalle zone di origine si è diffusa nel corso dei secoli gradualmente verso tutte le altre parti del mondo (Fig. 1.1).
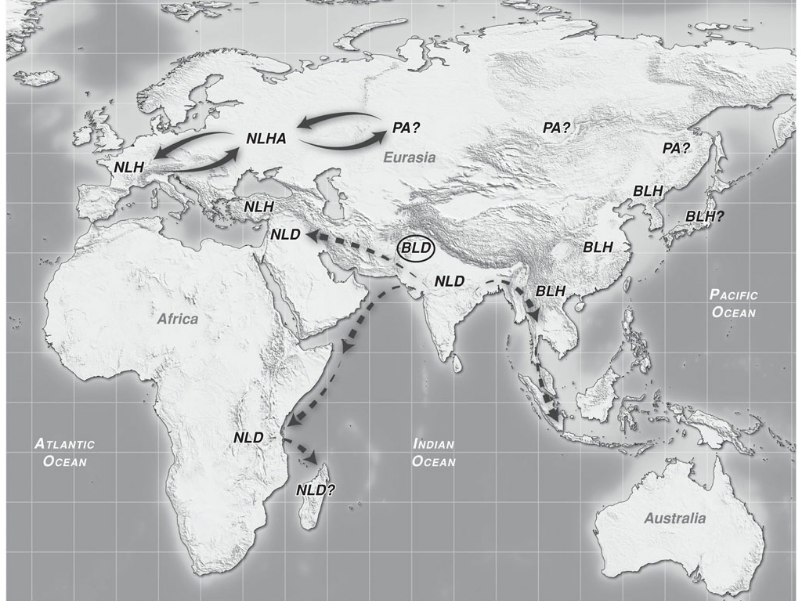
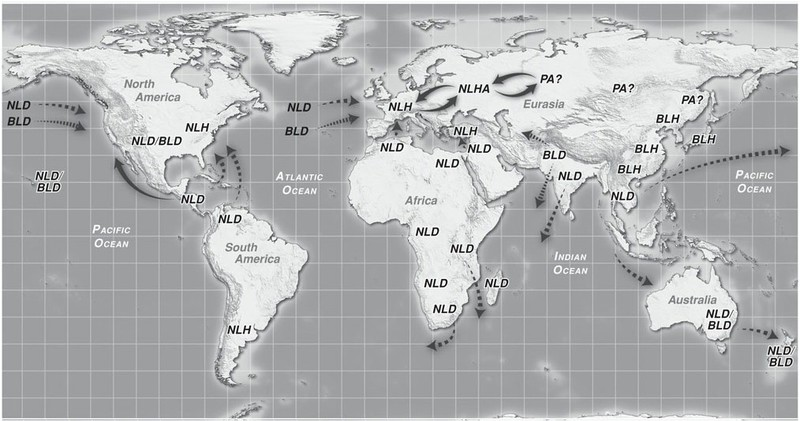
La prima fase della dispersione primaria, che trova prova nei ritrovamenti antichi cinesi ed europei sopra descritti, continua nella seconda fase della storia antica della Cannabis, con una rapida diffusone anche verso il continente africano e nel sudest asiatico, mentre in europa e in cina se ne consolida definitivamente l'uso.
La cannabis fu utilizzata dagli Assiri, che ne appresero le proprietà psicoattive dagli Arii e grazie ad essi, fu fatta conoscere ed utilizzare anche a Sciti e Traci, che cominciarono a farne uso anche durante i loro riti religiosi. (Cunliffe, Barry W., The Oxford Illustrated History of Prehistoric Europe, Oxford University Press, 2001, p.405)
Al nome “Sciti” (Skythai) utilizzato dagli antichi Greci corrisponde un insieme di tribù nomadi che vissero fra il VII secolo a.C. e il III secolo d.C. attorno al Mar Nero. A queste popolazioni viene oggi dato il nome di Sciti europei o del Ponto. L’origine di queste popolazioni è stata alquanto dibattuta fra gli studiosi, sebbene vi sia oggi concordanza in una loro origine asiatica. Il fulcro regionale dei proto-Sciti è probabilmente da ascrivere alle estese regioni degli Urali meridionali e delle zone del Mar Caspio e del Lago d’Aaral, e vi sono evidenze per strette relazioni e genesi culturali con le antiche Culture Kurgan dell’Asia centrale.
I Greci incontrarono gli Sciti del Ponto a partire dal VII secolo d.C. nel corso della loro colonizzazione del Mar Nero. Erodoto, che scrisse le sue Storie attorno al 500 a.C., descrisse ampiamente la storia e i costumi di queste popolazioni scitiche. In un suo famoso passo riportò l’uso della Cannabis da parte degli Sciti, internamente a una cerimonia di purificazione eseguita dopo la sepoltura di un re:
“Compiuta una sepoltura, gli Sciti si purificano nel seguente modo. dopo essersi unto e deterso il capo, al corpo fanno questo: piantati tre pali inclinati l’uno verso l’altro, vi stendono sopra tutt’intorno coperte di lana e, stringendole il più possibile, gettano pietre arroventate in una conca posta in mezzo ai pali e alle coperte.
Nasce presso di loro una pianta di canapa, assai simile al lino fuorché per spessore e grandezza: da questo punto di vista la canapa supera di molto il lino. Essa nasce sia spontanea sia seminata, e i Traci ne fanno anche vesti assai somiglianti a quelle di lino, e chi non fosse assai esperto non potrebbe distinguere se sono di lino o di canapa; chi poi non conosce ancora la canapa, riterrà senz’altro che la veste sia di lino.
Gli Sciti dunque, dopo aver preso semi di questa canapa, si introducono sotto quelle coperte, e poi gettano i semi sopra le pietre roventi. Il seme gettato fa fumo ed emana un vapore tale che nessun bagno a vapore greco potrebbe vincerlo. Gli Sciti mandano urla di gioia soddisfatti da questo bagno, perché non si lavano il corpo con acqua” (Plinio, Historiae, IV, 73(2)-75, nella traduzione di Augusta Izzo D’Accini, 1984, Mondadori, Milano, vol. 2, pp. 253-5).
Le ricerche archeologiche parrebbero aver confermato questa particolare pratica di uso della canapa. Nel sito archeologico della valle del fiume Pazyryk, nelle montagne dell’Altai orientale e a un’altitudine di 1600 metri sul livello del mare, sono state portate alla luce alcune decine di tombe a tumulo (kurgan), risalenti al 500-300 a.C. Queste tombe, appartenenti al ciclo culturale dei “Grandi kurgan dell’Altai”, si sono conservate nel ghiaccio e sono in relazione con le popolazioni scitiche asiatiche. Nel kurgan di Pazyryk 2, scavato nel 1947-48 da Sergei Ivanovich Rudenko, vi erano seppellite le mummie di una donna e di un uomo, quest’ultimo un probabile condottiero dell’età di circa 60 anni. Come in tutte le inumazioni di Pazyryk e di altri kurgan eurasiatici, il cadavere veniva sottoposto a un trattamento di mummificazione prima della sepoltura, con estrazione del cervello mediante trapanazione cranica e di tutti gli organi interni e dei muscoli. Accanto ai resti di sette cavalli sacrificati nel corso del funerale e a diversi utensili, strumenti musicali, specchi, nella sepoltura dell’uomo di Pazyryk 2 è stato ritrovato un calderone di bronzo con due manici, che era stato coperto con della corteccia di betulla; nel suo fondo è stato ritrovato del feltro, mentre la parte superiore era stata riempita con delle grosse pietre. Fra queste pietre sono stati ritrovati semi di canapa, alcuni dei quali erano carbonizzati.
Alcuni dei semi di canapa ritrovati nell’inumazione maschile del kurgan di Pazyryk 2 (da Russo, 2007, fig. 8, p.
1635)
Al di sopra del calderone sono stati ritrovati sei pali che erano legati insieme nella parte superiore per formare una specie di struttura per una tenda a cui era probabilmente sospeso il calderone. Accanto al calderone sono state ritrovate rimanenze di una coperta di cuoio decorata con motivi animali e che era forse servita per coprire la struttura in modo da completare la tenda per permettere l’inalazione dei vapori dei semi di canapa.
Tripode sopra a un incensiere di rame, uno strumento per l’inalazione dei fumi di canapa. Pazyryk (Altai
orientale, 500-300 a.C.) (da Popescu et al., 2001, fig. 134, p. 140)
In un altro angolo dell’inumazione è stata ritrovata un’ulteriore struttura a sei pali coperta con corteccia di betulla, sotto alla quale v’era un braciere rettangolare a quattro gambe e il cui interno era riempito di pietre e di altri semi di canapa (Rudenko, 1970).
Braciere di bronzo ritrovato nel kurgan di Pazyryk 2, contenente semi carbonizzati di canapa (da Jettmar, 1981, p. 532)
Una camicia associata all’inumazione dell’uomo di Pazyryk 2, conservatasi quasi integralmente, è risultata essere
costituita da due tipi di tessuto, canapa e kendyr, quest’ultimo ricavato da una specie di Trachomitum, della famiglia delle Apocynaceae (Rubinson, 1990).
Camicia ritrovata nell’inumazione di Pazyryk 2, costituita di canapa e kendyr (da Charrière, 1979, fig. 320, rip. in
Rubinson, 1990, p. 51, fig. 4)
Anche in un’inumazione dei kurgan del sito archeologico di Shumaevo, localizzato nel distretto russo di Tashlinsky della regione di Orenburg, al confine con il Kazakhstan, sono stati ritrovati semi di canapa all’interno di una faretra. L’inumazione appartiene alla cultura Sarmata tarda del secondo secolo d.C. (Morgunova & Khokhlova, 2006). Ulteriori evidenze del rapporto degli Sciti con la canapa sarebbero venute alla luce in Ucraina (Pashkevich, 1999). Ma la pratica di bruciare semi su dei bracieri potrebbe essere molto più antica della cultura scita; sono stati ritrovati semi di canapa carbonizzati in un’inumazione (tumulo n. 12) in un sito della cultura neolitica Kurgan a inumazioni a fossa (pit-grave) nei pressi di Gurbanesti, un villaggio distante una cinquantina di chilometri da Bucarest, in Romania, e datato attorno al 2000 a.C. (Rosetti, 1959: 801). Semi di capana sono venuti alla luce anche in un vaso collocato vicino alla testa di un’inumazione dell’Età del Bronzo nella regione settentrionale del Caucaso (Markovin, 1963, p. 98, cit. in Ecsedy, 1979, p. 45).
E’ stata suggerita l’ipotesi che le lastre di pietra a forma di montone, rinvenute in Siberia e nell’Asia centrale, fossero forse altari portatili che servivano per bruciare semi e altri prodotti della Cannabis (Jettmar, 1964-65).
Nel passo sopra riportato Erodoto parla dei soli semi di canapa che venivano bruciati per produrre le esalazioni purificatrici, e nei resti archeologici sono effettivamente stati ritrovati solamente i semi di canapa. Non sono note proprietà inebrianti dei semi di questa pianta, e il rito scita descritto da Erodoto e confermato dagli scavi archeologici poteva aver avuto solamente scopi purificatori e non inebrianti. Tuttavia, la pratica di inalare i fumi dei semi bruciati di canapa comporta molto probabilmente la conoscenza degli effetti inebrianti dei fumi del resto della pianta e della sua resina.
La presenza della Cannabis nell’antico Egitto è stata oggetto di discussioni fra gli studiosi che si sono occupati del tema. Per alcuni autori, antichi e moderni, la canapa era totalmente sconosciuta fra gli antichi Egiziani (si vedano ad esempio Woenig, 1897, p. 189 e Germer, 1985, p. 23). Ma i dati archeologici e linguistici parrebbero contraddire quest’affermazione troppo recisa.
Da un punto di vista dell’evidenza diretta, cioè delle rimanenze materiali della pianta, sono venuti alla luce scarsi reperti. Resti di tessuto di canapa sono stati ritrovati ad El-Amarna nella tomba di Amenhotep IV (Akhenaton), un faraone che regnò nel XIV secolo a.C. (Martin, 1989, vol. II, p. 256). La presenza di polline di Cannabis è stata identificata nel suolo del sito di Nagada, in uno strato datato alla metà del III millennio a.C. (Emery-Barbier, 1990) e, sorprendentemente, all’interno della mummia di Ramesse II, faraone che morì agli inizi del 1200 a.C. (Leroi-Gourhan, 1985). V’è una generale difficoltà di distinguere fra i pollini del genere Cannabis e quelli del genere Humulus (cui appartiene il luppolo), entrambi della famiglia delle Cannabaceae, ma in questo caso non vi dovrebbero essere dubbi, poiché il genere Humulus non sembra fosse presente nell’antico Egitto (Russo, 2007, p. 12). Polline di canapa è stato ritrovato anche in una mummia del periodo tolemaico, datata attorno al 100 a.C. (Girard & Maley, 1987).
Per quanto riguarda gli aspetti linguistici, Dawson (1934) ha proposto l’identificazione del nome e del geroglifico ŝmŝmt (shemshemet) con la Cannabis. Il primo riferimento a questo nome si trova nei Testi delle Piramidi (§514) ed è datato al 2350 a.C. Vi si legge: “Il Re ha legato le corde della pianta ŝmŝmt”; ciò ricondurrebbe all’utilizzo della canapa per la sua fibra.
Il medesimo simbolo geroglifico si ritrova in diversi papiri medici scritti nella lingua ieratica. Nel Papiro Ramesseum III, datato attorno al 1700 a.C., si legge: “Un trattamento per gli occhi: sedano; ŝmŝmt; viene pestato e lasciato nella rugiada per tutta la notte. Entrambi gli occhi del paziente devono essere lavati con questo alla mattina” (A 26). E’ stato suggerito che si tratti di un rimedio antico per il glaucoma.
Nel Papiro di
Ebers, redatto durante la XVIII Dinastia (1550-1295 a.C.), si legge un rimedio di natura ostetrica: “Un altro medicamento
per raffreddare l’utero ed eliminare il suo calore: ŝmŝmt; pestare in miele; introdotto nella sua vagina. Questa è una contrazione”. In un altro passo del medesimo Papiro la pianta ŝmŝmt è indicata
come uno degli ingredienti per la cura dei vermi alle unghie dei piedi.
Nel Papiro di
Berlino, redatto durante la XX Dinastia (1186-1069 a.C.), al passo 81 si legge: “Un rimedio per trattare l’infiammazione:
foglie [o cime?] di ŝmŝmt; olio bianco. Da usare come un unguento”.
Nel Papiro Chester Beatty, del medesimo periodo del Papiro di Berlino, si legge un rimedio per un’affezione anale chiamata kapou, apparentemente un tipo di infiammazione: “Come lavaggio, per cacciare via le sostanze brucianti chiamate kapou nell’ano e per rinfrescarlo: ŝmŝmt ¼; la pianta djaret: 1/32; acqua mesta: 25 ro. Ciò verrà posto nell’ano, seguendo per quattro giorni” (Bt 24) (Per questi e altri passi nei papiri medici si vedano Russo, 2007 e Manniche, 1989, pp. 82-3; le datazioni dei papiri qui citati sono state prese da Nunn, 1996, p. 210).
Tra il 2000ac e il 1000 ac, nella seconda fase della Dispersione Primaria, si assiste ad un'ulteriore espansione verso il continente Africano ed Europeo ad opera delle popoli come Hittiti, Assiro Babilonesi, Egiziani e Fenici.
La prima e più famosa tavoletta medica Assira in cui compare la parola Canapa (British Museum of London )
Avicenna (1037ac- 980ac), scienziato medico, filosofo, matematico e fisico persiano vissuto intorno all'anno 1000 ac definito nell'antichità come il “Principe dei medici”, scrisse più di 250 opere su vari argomenti scientifico religiosi, dedicando alla Canapa un intero capitolo di una delle sue più importanti opere Il “Canone della Medicina”, in cui tramanda l'utilizzo medicinale della Canapa secondo la tradizione medica ayurvedica indiana.
Successivamente i Greci e Romani aiutarono a completare la diffusione della coltivazione della Canapa nel continente Europeo e nel bacino del Mediterraneo.
Nel 500 ac la coltivazione della Canapa è considerata coltura stabile per la produzione di fibra e semi.
Si nota che, maggiormente ci si allontana dalla zona di origine della pianta, sempre più si sfuma la tradizione degli utilizzi magico, religiosi o medicinali, a differenza dell'uso tessile, che risulta il più apprezzato e sfruttato nelle culture occidentali.
Nonostante, nell'Europa centrale, ancor prima dell'espansione dell'Impero romano, la cannabis era già coltivata ed usata nelle isole britanniche dalle tribù dei Celti e dei Pitti (III- IV sec a.C.).
Plinio il Vecchio nella Naturalis Historia menziona le proprietà terapeutiche dell'erba, e ulteriori riferimenti si possono trovare nell'Antica Juliana del medico Nerone Discoprite.
Pubblicata nel 70 d.C., la “Materia medica” di Dioscoride, l’erbario più importante dell’antichità, contiene la più antica raffigurazione della pianta; Dioscoride la raccomanda per mal d’orecchi, edemi, itterizia e altri disturbi. Secondo Galeno le preparazioni di canapa sono utili contro le flatulenze, il mal d’orecchi e tutti i tipi di dolore. Lo stesso Galeno metteva in evidenza che, se si esagera con le dosi, “colpiscono la testa, immettendovi vapori caldi e intossicanti” (Walton, 1938).
I passaggi di Plinio, Marco Polo, Abu Mansur Muwaffaq e The Arabian Nights dimostrano senza ombra di dubbio che la cannabis era coltivata sia per la sua fibra sia per le sue proprietà psicoattive in tutta l’Asia, il Medio Oriente e gran parte dell’area del Mediterraneo.
Nei secoli dopo Cristo la documentazione diretta – tessuti, carta, cordami di canapa – diventa più frequente fra i reperti archeologici in tutta la Cina (Li, 1974a). Citiamo qui il reperto riguardante il cosiddetto “uomo di Yingpan”, una mummia di un uomo scoperto in una necropoli del bacino di Tarim, a Yingpan, nella regione occidentale cinese dello Xinijiang e datata attorno al 300 d.C. Il viso dell’uomo è coperto da una maschera fatta di canapa e di gesso, mentre la tunica, riccamente addobbata, è di seta con fili d’oro. Le fattezze fisiche ed artistiche dell’”uomo di Yingpan” lo riconducono a una tipologia occidentale, caucasoide, e non cinese (cfr. Knauer, 1999).
L’utilizzo in Cina della canapa come fibra, cibo, medicina e come droga psicoattiva è attestato, oltre che dai dati archeologici, dalle fonti scritte, alcune delle quali risalgono al secondo e al primo millennio a.C.
Uno dei riferimenti più antichi si ritrova nel testo Shih Ching (“Libro delle Odi”), del periodo della dinastia Chou (1046-256 a.C.), dove la canapa viene riportato come fibra e come seme alimentare. Viene descritta brevemente la sua coltivazione e la preparazione della fibra per l’impiego come fonte tessile.
Del medesimo periodo Chou sono il Li Chi (“Documenti dei Riti”) e il Chou Li (“Riti di Chou”), dove viene riportato in maniera alquanto dettagliata l’uso dei vestiti di canapa. Nel Li Chi vengono date istruzioni sull’uso di vestiti di canapa in occasione dei riti funebri, una tradizione che si è tramandata per secoli sino ai tempi moderni. Nel medesimo testo, i semi di canapa sono indicati come un importante alimento usato dai re durante certi periodi dell’anno.
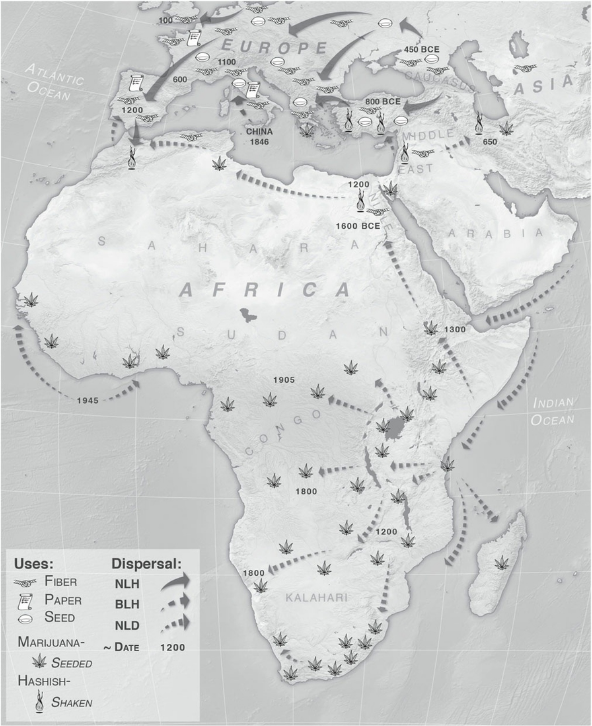
L’uso della cannabis era diffuso anche in Africa secoli prima della colonizzazione europea. In Africa la cannabis era coltivata, utilizzata come fibra e come medicinale, inalata e a volte venerata in aree diversissime: dal Sud Africa al Congo al Marocco.
Si suppone che l'introduzione della cannabis in Africa risalga circa al 4000 ac, comunque le prime tracce nei ritrovamenti risalgono al periodo tra il 2000 ac e il 500 ac (Merlin 2003, Burny 1994, Van der Merwe 1975,2005).
L'uso della Cannabis in Africa venne tramandato soprattutto per motivi religioso medicinali attraverso due vie, una a nord della vasta distesa del deserto del Sahara, ostacolo naturale alla propagazione della cannabis, l'altra a sud di questa vasta area, diffondendosi dalle coste verso l'interno alla conquista diell'intero continente.
Cannabis Medicinale e storia antica
Dispersione Secondaria Fase III a 500ac -1545
Inizia la fase di Dispersione Secondaria, precisamente la fase III, in cui avviene il consolidamento definitivo della coltivazione nell'area del mondo conosciuto prima della scoperta delle Americhe.
Si coltiva Cannabis per uso tessile in Europa, Asia, Indocina, Africa, India.
L'utilizzo medicinale risulta in secondo piano in questo periodo. Tramandato più da parte di quei popoli con una solida e antica cultura di
medicina tradizionale come i Cinesi o gli
Hindu o gli Arabi, vicini alla zona di origine della pianta, mantiene invece, nel mondo occidentale la valenza di fonte primaria di fibre per corde e
tessuti.
Comunque durante tutto il primo millennio dopo la nascita di Cristo, la Cannabis è stata un famoso rimedio a molte malattie diffuse in tutta Europa. Nel medioevo fu proibita in Spagna alla fine del VII secolo, e in Francia VIII, con accuse di stregoneria a chi facesse uso di Canapa. Carlo Magno invece, riportandola in voga, nel IX secolo esaltava la Canapa, la voleva coltivata su larga scala come materia prima preziosa per produrre tessuti, vele, cordame, e olio da lampade. In seguito furono i viaggiatori provenienti dall'Africa e dall' Asia a riportarla alla luce nel continente Europeo, divulgandone nuovamente l'uso medico.
La suora tedesca Idelgarda di Binden 1098-1179, colta erborista e guaritrice, studente di medicina greca antica e paganesimo curativo, ne apprese nuovamente l'uso e la nomina nella sua opera di scienze naturali “Physia” con descrizioni acutissime e precise.
Giovanna d'Arco 1412-1431 fu accusata di utilizzare “erbe diaboliche” per i riti di stegoneria, tra cui la Canapa, poco prima che, durante il periodo dell' Inquisizione, nel 1484, la Bolla Papale “Summis desiderantes”, di Papa Innocenzo VIII, vieta l'utilizzo ai fedeli di qualunque erba medicinale o allucinogena tra cui la Canapa, eccetto l'utilizzo del vino in uso nella pratica religiosa.
Nonostante la forte influenza della Chiesa, comunque, non si riuscì a impedire la diffusione in Europa settentrionale, come in Olanda e Danimarca, dove, ancor oggi è più accettata.
Intanto anche i monaci amanuensi, contravvenendo alla bolla Papale, copiavano i loro testi sacri su carta di Canapa.
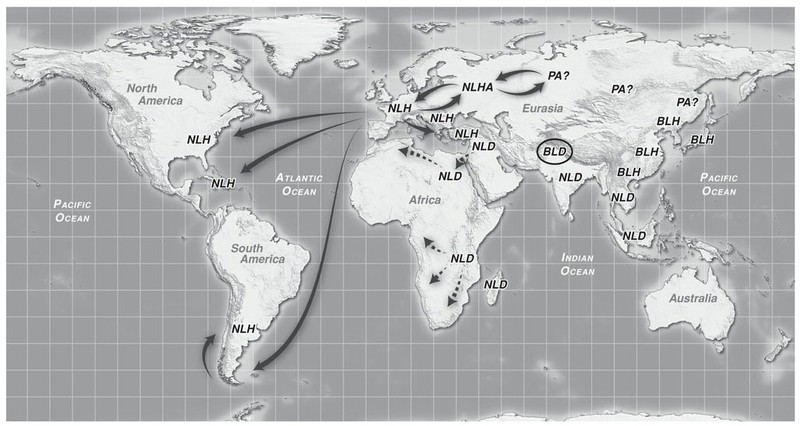
Cristoforo Colombo giunse in centro America nel 1492 sulle sue famose Caravelle, equipaggiate con vele e corde di Canapa.
I più ritengono che dopo la scoperta dell’America ingenti quantità di canapa siano state importate sia dai conquistadores che da inglesi e francesi, per assolvere alla produzione delle fibre per i diversi usi e della carta, come avveniva in Europa. Altri ritengono che la canapa abbia attraversato lo stretto di Bering con le popolazioni asiatiche (abitanti le regioni degli attuali Giappone, IndoCina, Tibet, Mongolia, Siberia e pianure del centro Asia) che, tra i 30 e i 15 mila anni fa (alla fine dell’ultima glaciazione), fecero rotta verso Est conducendo la prima emigrazione verso il lontano continente americano. Gli Indiani d’America, secondo questa tesi avrebbero già conosciuto le virtuose proprietà della pianta. Non abbiamo però reperti o prove a supporto.
E' il 1545 che viene considerato l'inizio ufficiale della coltivazione in messico e in Cile.
Pedro Cuardado, un conquistador dell'esercito di Cortez, iniziò in quel periodo un fiorente commercio e coltivazione di canapa nel messico centrale. Pochi anni dopo, nel 1550 il governatore spagnolo emise un ordinanza che tentava di "limitare la coltivazione poichè i nativi avevano iniziato ad usare la cannabis non solo per la fibra" (Abel 1980, Monsk 1939).
Al contrario in Cile, sempre dal 1545, viene stimolata la produzione da fibra, con l'obbiettivo di sottrarre alla Russia il posto di primo produttore mondiale.
La Cannnabis arrivò nel nord America a Port Royal, Nova Scotia nel 1606, grazie a Louis Hébert, considerato il primo farmacista canadese.
Inizia con l'arrivo della cannabis nel nuovo mondo nel 1545 la seconda parte della Fase III della Dispersione Secondaria, che durerà sino al 1800 circa.
La Canapa fu utilizzata dal Medico, scrittore, umanista francese Francois Rabelais che nella sua opera del 1532 “Gargantua e Pantagruel”, la elegge come “Regina dei vegetali”, vantandone “azione antibiotica in grado di uccidere qualsiasi tipo di verme”. Nel capitolo 51 del terzo libro dell'opera, si attribuisce a Pantagruel la scoperta della Canapa, nominata dunque “Pantagruelione”.
Al servizio del Vcerè di Goa invece il medico portoghese Garcia da Orta cita la pianta nel suo libro “Colloqui sui semplici e sulle droghe dell'India”, 1563, attribuendole proprietà in grado di stimolare l'appetito, il sonno, la tranquillità, ma anche come afrodisiaco ed euforizzante.
Nel 1610 l'inglese Robert Burton, autore di “Anatomia della Melancolia” indica la Canapa come cura della depressione, per la quale è considerata !rimedio molto sicuro”.
Il New London Dispensary nel 1621 sosteneva l'importanza della Canapa nella cura della tosse ed itterizia.
In questo periodo i Puritani inglesi portarono i semi di Canapa nelle Americhe, introducendo l'impiego industriale di questa pianta, mentre l'uso medico ed inebriante, presumibilmente divulgato dagli schiavi arrivati con la tratta dall'Africa, divenendo un rimedio conosciuto ai nativi Pellerossa. Nell'attuale Zimbabwe, per esempi la Canapa è da sempre conosciuta ed utilizzata in medicina tradizionale come antidoto per il veleno di serpenti o come rimedi per la malaria, antrace, dissenteria e “medicina di guerra”.
I presidenti degli Stati Uniti Thomas Jefferson e George Washington possedevano campi di Canapa, Benjamin Franklin possedeva una cartiera che trasformava Canapa.
Lo stesso George Washington conosceva le proprietà medicinali della pianta.
Nel suo diario nell'agosto 1765, lamentava di aver separato le piante maschili dalle femminili troppo tardi, lasciando avvenire l'impollinazione, a discapito della qualità dei fiori. (Joseph W. Jacoph op p.32)
La Canapa è stata anche moneta in corso legale negli Stati Uniti per quasi 200 anni, fino all'inzio del 1800, quando le tasse potevano essere pagate con questa pianta.
Altri presidenti americani del periodo antecedente al proibizionismo, ne hanno elogiato le qualità favorendone la coltivazione: James Madison, James Monroe, Franklin Pierce, Zachary Taylor.
Nel 1753 Linneo battezzò la canapa Cannabis sativa, considerando l'esistenza di un'unica specie, mentre nel 1783 Lamarck ritenne, sulla base di significative differenze morfologiche, di dover distinguere il genere Cannabis in due specie distinte: la C. sativa, nativa dell'Europa, e la C. indica, propria dell'oriente.
L’industria della canapa da fibra fiorì tra il 1840 e il 1860 nel Kentucky, nel Missouri e nell’Illinois grazie alla forte domanda dell’epoca per la realizzazione di tele per vele e cordami (Ehrensing, 1998). Fino alla prima metà del 19° secolo, la canapa era la principale fonte di fibra tessile di origine vegetale e, in effetti fu descritta come "la regina della fibra, lo standard di riferimento per tutte le altre fibre" (Boyce 1900).
Da questa parte dell'atlantico invece Napoleone volle proibirla in Egitto, con un editto pubblicato l'8 ottobre 1800 recitante “L'uso della bevanda che alcuni musulmmanni preparano con la canape e il fumare i semi di canape sono proibiti in tutto l'Egitto. Coloro che hanno queste abitudini perdono la ragione e sono presi da deliri violenti che li spingono ad eccessi di ogni specie”.
La Cannabis Medicinale e Terapeutica Moderna
Si deve attendere sino al diciottesimo secolo per la prima descrizione moderna delle proprietà terapeutiche della Cannabis, attribuita al medico irlandese W. S. O’Shaughnessy, che sulla base delle sue esperienze in India, ne fece conoscere le virtù alla comunità medica europea.
Laureatosi a Dublino nel 1831, dedicò la prima parte della sua esperienza clinica allo sviluppo della prima terapia volemica endovenosa, sviluppata come terapia, dall'osservazione di numerosi casi di colera.
Si trasferisce dunque in India per perfezionare i suoi studi e lì nota alcuni benefici derivanti dalla somministrazione terapeutica della Cannabis, in una forma e qualità differente dalla pianta conosciuta in Europa, con più marcate e soddisfacenti proprietà medicinali.
La trattazione di O’Shaughnessy si arricchisce di dettagli storici sugli usi della canapa conosciuti da scrittori sanscriti, arabi e persiani. Si dedica particolarmente all'osservazione della patologia tetanica. La cannabis non guariva dal tetano, ma era utilizzata come medicinale coadiuvante per mitigare alcuni fastidiosi sintomi.
O'Shaughnessy, W.B. (1839) Case of Tetanus, Cured by a Preparation of Hemp (the Cannabis indica.), Transactions of the Medical and Physical Society of Bengal 8, 1838-40, 462-469
Approfondita la conoscenza di questa pianta, entusiasta, ne riporta i semi e il frutto delle sue osservazioni scientifiche in Inghilterra, denominandola Canapa Indiana o Cannabis Indica, per differenziarla dalla versione Europea da fibra.
Sulla scorta delle informazioni di O’Shaughnessy si diffonde in Inghilterra prima, e nel resto dell'Europa poi, un fervido interesse per questa “nuova” varietà di Canapa Indiana e soprattutto della resina che se ne ricavava, l'Hashisch.
Si racconta che la regina di Gran Bretagna Vittoria, sulla scorta delle informazioni del medico Irlandese, ricorresse alla canapa per lenire i dolori mestruali e durante il suo regno la Canapa veniva usata per curare diversi malanni, dagli spasmi muscolari ai reumatismi.
In Francia l'uso dell'Hashisch divenne rapidamente una vera e propria moda: introdotto dallo psichiatra francese Jacques-Joseph Moreau, che nel 1840 descrisse gli effetti della droga in una relazione scientifica dopo averla provata su di sé, si diffuse ben presto specie negli ambienti artistici di quel tempo; tanto che a Parigi nacque il “Club des Hashischins” frequentato da poeti e scrittori quali Victor Hugo, Alexandre Dumas, Charles Baudelaire, Honoré de Balzac e Théophile Gautier.
In questo contesto storico non così lontano, l'Italia, in quest'ambito, si colloca come nazione leader nella ricerca internazionale.
Pionieri in questo settore furono gli scienziati Giovanni Polli, Medico laureato a Pavia nel 1837, Direttore della rivista milanese Annali di Chimica Applicata alla Medicina, e Carlo Erba, farmacista di Milano, che per primi importarono la conoscenza della sostanza dall'ambiente scientifico internazionale e ne sperimentarono gli effetti su sé stessi a Milano, il 19 giugno 1847, in un esperimento scientifico in compagnia di Francesco Viganò e Pietro Mordaret. (VERGA ANDREA, 1847, Lettera sull’haschisch, Gazzetta Medica di Milano, 10 luglio 1847, pp. 263-264.)
Sono diversi i medici che con molta curiosità si sottopongono successivamente alle prime “esperienze cannabiche” della storia italiana. Tra questi Andrea Verga, Cesare Lombroso, Filippo Lussana e Giulio Ceradini. Le sessioni di ingestione di haschich venivano puntualmente osservate da una platea di medici e scienziati e prontamente descritte nei dettagli. (LUSSANA FILIPPO, 1851, Alcuni effetti dell’Hachisch, Gazzetta Medica di Milano, vol. 2 (3° s.) pp. 441-442. - CERADINI GIULIO, 1864, Relazione di alcuni effetti dell’haschisch provati da G.C., Annali di Chimica Applicati alla Medicina, vol. 38 (3° s.), pp. 111-127. - Verga Andrea, 1848, Sull’haschisch, Annali Universali di Medicina, 127:423-425; Verga Andrea, 1848, Diversi preparati di haschisch, Gazzetta Medica Lombarda, 2° s., 1:79; Verga Andrea, 1863, Lipemania guarita coll’haschisch, Gazzetta Medica Italo-Lombarda, 32 (5° s.), 2°:275.)
Il farmacista Carlo Erba
Ritratto del Dott. Giovanni Polli
Inizia un fiorente periodo di ricerca presso la comunità scientifica Italiana sotto il profilo botanico, tassonomico, analitico, chimico, farmaceutico, tossicologico, fisiologico, e terapeutico.
Il primo lavoro risale proprio a quell'anno per mano di Antonio Maurizio Zumaglini, noto medico e botanico che studiò all'Università di Pisa, ed intraprese nella sua città natale di Biella, studi botanici e tassonomici accurati, scrivendo tra il 1849 e il 1860 la monumentale opera in latino “Flora Pedemontana”, in cui si cita la Canapa e descrive i suoi svariati usi medicinali.
Ricordiamo l'importante contributo di Giovanni Briosi e Filippo Tognini, botanici dell’Istituto Botanico della Reale Università di Pavia, questi due ricercatori intrapresero uno studio approfondito sui caratteri botanico-tassonomici della famiglia delle Cannabinacee e del genere Cannabis. Questa voluminosa opera rappresenta un contributo pionieristico sugli aspetti botanici della cannabis di importanza internazionale.
Il lavoro è corredato di una cinquantina di stupende tavole anatomiche a colori disegnate dai due autori. (BRIOSI GIOVANNI & FILIPPO TOGNINI, 1888, Contributo allo studio dell’anatomia comparata delle Cannabineae, Atti Istituto Botanico Pavia, II° s., vol. 2. BRIOSI GIOVANNI & FILIPPO TOGNINI, 1894, Intorno alla anatomia della canapa (Cannabis sativa L.). I. Organi sessuali, Atti Istituto Botanico Pavia, N.S., vol. 3, pp. 91-209. BRIOSI GIOVANNI & FILIPPO TOGNINI, 1895, Intorno alla anatomia della canapa (Cannabis sativa L.). II. Organi vegetativi, Atti Istituto Botanico Pavia, II° S., vol. 4, pp. 169-329. )
Il Dott. Pietro Brugo, Raffaele Velieri, Vignolo e Marino Zuco e Godard si dedicarono soprattutto a ricerche sulla preparazione galenica e la valorizzazione delle sostanze attive.
Scrive Pietro Brugo, farmacista e chimico farmaceutico, a Romagnano, provincia di Novara negli annali di Chimica Applicata alla Medicina, 1864, vol. 39 (3°s.), pp. 249-250.
“Prendo una data quantità di foglie fresche di canape sativa r accolte nell'epoca della fioritura, setacciato bene, indi le mescolo con olio d'olivo di buona qualità q.b. [quanto basta] per ottenere una poltiglia molle: la quale, in apposito recipiente, faccio macerare per 24 ore alla temperatura di ±40 C circa; passo quindi per tela con forte pressione.
Il liquido espresso posto in un imbuto o robinetto, si divide dopo qualche tempo in due strati, uno superiore, che è un olio denso di un color verde cupo, leggiermente aromatico, ricordante l 'odore della pianta verde; l'inferiore è un liquido castagno scuro, che concentrato debitamente presenta l'aspetto d'un estratto acquoso. Separati questi due strati feltro per carta l'olio, il quale lascia per residuo sul feltro una sostanza grassa d'un magnifico verde smeraldo.
Tutte e tre questi prodotti, olio, estratto, e sostanza verde, hanno a d un dipresso le stesse virtù medicamentose, e se passa fra loro qualche piccola differenza l'attribuisco piuttosto al diverso loro grado d'assorbimento, che ad altro.
L'olio così preparato lo trovai d'un effetto marcatissimo, non solo negli indurimenti delle glandule, e negli ingorghi lattei, ma anche nei dolori articolari acuti qualunque sia la loro causa, e perfino nella gotta, nel qual caso se ne toglie il male , mitiga di gran lunga l'acutezza del dolore. “
Scrive Raffaele Valieri, Medico Primario dell'Ospedale degl'Incurabili e Fondatore del Gabinetto d'Inalazione (Stabilimento Tipografico dell'Unione, Napoli, 32 pp.,) nel 1887 “Sulla canapa nostrana e suoi preparati in sostituzione della Cannabis indica”, ponendosi per primo il problema della qualità farmaceutica della droga vegetale e sottolineando la variabilità qualitativa dei materiali reperibili all'estero, ponendo la necessità di una produzione standardizzata farmaceutica.
“Spettava al terapista moderno la parola più solenne e precisata sulla vera azione della canapa ed assegnarle il vero suo posto in terapia. Egli nella sintrome fenomenica e nelle sue conseguenze non vede che l'abuso della sostanza, la poca conoscenza della sua composizione e l'ignoranza sulla sua quantità: onde dall'altro lato considerando che tolto l'abuso, conosciuta la entità del farmaco ed amministrato a dosi moderate e graduate possa riescire vantaggioso in molte malattie nervose come accade per i più possenti veleni, che dati a dosi frazionate e ponderate riescono i più possenti rimedi: allora invece di un eccitante morbigeno si avrà nelle sue mani un farmaco benefico.[...]
[...]L' introduzione della canapa indiana in terapia come tutti i rimedi di grande efficacia e di svariata applicazione ebbe i suoi entusiasti sostenitori, come lo sono io, e i suoi scettici oppositori- ed è giustificata questa contradizione, quando si rifletta che trattandosi di una droga che viene da distanti regioni, talvolta di problematica e misteriosa preparazione e che viene amministrata in modo empirico ed in peso convenzionale. Onde non si può fare assegnamento nazionale e certo sulle sue qualità terapiche, come sopra altre medicine di conosciuta composizione chiimica, di costante ed identica preparazione, di mistione ufficinale conosciuta. Giustamente perciò dice il
Tamburrini. "Si può dire in generale che le indicazioni terapiche della droga hanno poco di determinato; e debbono perciò essere studiate più largamente e con maggior rigore!"[...]
[...]A torto si è voluto paragonare l'azione della cannabis indica a quella degli oppiati od altri narcotici, a quella degl'ipnotici, de' calmanti, sedativi, a quella degli altri eccitanti del sistema nervoso cerebrale. Non ha analogia coll'oppio, coi bromuri, col cloralio, col coca ec. - La sua azione fisiologica e terapica è sui generis. Bisogna studiarla come una entità igienico-terapica speciale nei suoi diversi preparati, nelle sue mistioni, nel metodo di amministrazione e nel peso -Bisogna precisare le malattie ed i suoi risultamenti clinici ed amministrarla sola e senza altri coadiuvanti narcotici, esilaranti o sedativi, quando si vuole avere la vera conoscenza della sua azione specifica.[...]
[...]La storia di tutti i tempi e di tutti i luoghi ha mostrato che l'uomo sia nello stato selvaggio che civile ha avuto una tendenza irresistibile ed istintiva alla ebrezza (Liebig) ancora a costo della sua vita; fumando e masticando l'oppio ed il tabacco; bevendo il coca, il vino, l'alcool, i liquori fermentati, masticando, fumando e bevendo l'ascisc ha cercato inebriarsi idealmente di quei piaceri che non può procurarsi, e per attutire i positivi dolori della vita.”
(VALIERI RAFFAELE, 1887, Sulla canapa nostrana e suoi preparati in sostituzione della Cannabis indica, Napoli, 32 pp. PIETRO BRUGO, 1864, Preparazione ed uso dell’olio di canape sativa: di Brugo farmacista a Romagnano, Annali di Chimica Applicati alla Medicina, vol. 39 (3°s.), pp. 249-250
VINGNOLO G., 1894, Sull’essenza di Cannabis indica, Rendiconti Reale Accademia dei Lincei, 5° s., vol. 3, pp. 404-407. VIGNOLO G., 1895, Sull’essenza di Cannabis indica, Gazzetta Chimica Italiana, vol. 25(I), pp. 110-114. VIGNOLO G. & F. MARINO-ZUCO, 1895, Sopra gli alcaloidi della Cannabis indica e della Cannabis sativa, Rendiconti Reale Accademia dei Lincei, (5° s.), vol. 4, pp. 253-25 -
GODARD, 1871, Preparazioni arabe dell’haschisch, Annali di Chimica Applicati alla Medicina, vol. 52 (3°s.), pp. 142-146 -)
Vengono coniati e definiti nuovi sostantivi come Asciscina, Cannabina, Cannabano, Cannibene, Cannabene, Oleito e Eleosaccaro e Cannabismo.
-cannabina (o canapina o asciscina) s. f. [der. di Cannabis, nome lat. scient. della canapa, col suff. -ina]. – Sostanza resinosa amara presente nella canapa indiana, già usata come ipnotico; si ottiene per precipitazione dall’infuso con acido tannico.
-cannabano s. m. [der. di Cannabis, nome lat. scient. della canapa, col suff. -ano]. – Idrocarburo isolato dall’olio essenziale della canapa indiana; è un liquido volatile di odore caratteristico.
-cannibène s. m. [der. di Cannabis, nome lat. scient. della canapa, col suff. -ene; la -i- per differenziarlo dal cannabene]. – Composto organico, sesquiterpene, contenuto nell’olio della canapa indiana; è un liquido volatile, incolore, di odore gradevole.
-cannabène s. m. [der. di Cannabis, nome lat. scient. della canapa, col suff. -ene]. – Composto organico, idrocarburo contenuto nell’olio della canapa indiana; per addizione di due atomi di idrogeno si trasforma in cannabano.
-cannabismo s. m. [der. di Cannabis]. – Uso continuato della droga estratta dalla canapa indiana (hascisc); provoca un grave decadimento dello stato fisico, con disturbi mentali come eccitamento maniacale e allucinazioni, che possono giungere fino all’oscuramento della coscienza e al delirio.
-Gli oleoliti sono soluzioni oleose dei fitocomplessi curativi delle piante officinali.
-Eleosaccaro. S. m. (Farm.) Medicamento formato di zucchero fioretto e di un olio volatile aromatico.
Il problema della standardizzazione sollevato da Raffaele Valieri, verrà in seguito affrontato su due fronti diversi. Si cita lo studio di Gino Pollacci e Mario Gallotti “Canapa indiana coltivata in Lombardia” (Bollettino della Società Italiana di Biologia Sperimentale, vol. 15, pp. 325-325, 1940)
“Dopo i buoni risultati ottenuti dal prof. B. Longo a Napoli, noi, fin dal 1937, tentammo l’ambientamento di questa pianta in Lombardia ed iniziammo la semina e la coltivazione nell’Orto Botanico di Pavia.
Raccolto il primo prodotto nel settembre dello stesso anno (costituito dalle sommità fiorite femminili), e fattone un estratto etereo, lo sottoponemmo a controllo biologico, che è stato eseguito dalla prof. Piera Marangoni, dell’Istituto di Farmacologia della nostra Università. L’esame fu fatto
su diversi conigli e topi e si venne alla soddisfacente conclusione che il prodotto si dimostra attivo. Incoraggiati da questi risultati si è tentata
in quest’anno una coltivazione su scala relativamente grande, seminando con nostri semi, detto vegetale nel Campo Sperimentale che l’Istituto Botanico ha impiantato alla Certosa di Pavia. Nel settembre ultimo raccogliemmo il prodotto che fu abbondante e promettente. Si ottennero circa 2
quintali di cime fonte secche, che stiamo ora sottoponendo a controllo biologico”.
Lo studio fornì il materiale per i successivi studi del Dott. Bazzi Mario, Farmacologo dell’Istituto di Farmacologia dell’Università di Pavia che, nel 1940, pubblicando i lavori “Dosaggio biologico della Cannabis indica coltivata nei dintorni di Pavia, Bollettino Società Italiana Biologia Sperimentale” e “Cannabis indica”, (Milano, Inverni della Beffa, 64 pp.), intraprese ricerche sulla Cannabis indica insieme a Pietro Mascherpa.
Egli utilizzò una parte di quel raccolto delle prime coltivazioni per effettuare studi sui cani e sui conigli. Sottolineò la difficoltà di reperire questa droga presso le farmacie, nonostante fosse iscritta alla Farmacopea Ufficiale Italiana e diede quindi importanza ai risultati ottenuti con la coltivazione su larga scala di Pavia, poiché ciò apriva la possibilità di rendere il mercato farmaceutico italiano indipendente dalle costose e rare importazioni da altri paesi. A conclusione dei suoi saggi e dosaggi biologici, egli affermò che la canapa coltivata a Pavia possedeva un’attività farmacologica pari al 50% di quella posseduta dalla canapa d’importazione.
Non meno importanti furono i primi studi fisiologici di Bourchardat e Corrigan e di Battaglia (BOUCHARDAT & CORRIGAN, 1847, Dell’haschisch, Annali di Chimica Applicati alla Medicina, vol. 4 (3°s.), pp. 201-204. -BATTAGLIA B., 1887, Sul Hashish et sua azione nell’organismo umano, Psichiatria (Napoli), vol. 5, pp. 1-38. ).
Gli studi e le ricerche Italiane spiccano a livello europeo per la qualità del lavoro di ricerca con metodo rigorosamente scientifico e per l'entusiasmo che accompagna questi lavori, diffuso a livello accademico in tutta Italia, dalla Lombardia a Napoli, a Roma, al Veneto alla Sardegna.
Non tardano a comparire le prime indicazioni terapeutiche come rimedio contro il colera e l'idrofobia, come calmante nel gozzo esoftalmico e nell'epilessia, come miotonico uterino, utile nell'ingorgo mammario delle puerpere, efficace come analgesico e spasmolitico.
POLLI GIOVANNI, 1854, Raccomandazione di un rimedio nel cholera, Annali di Chimica Applicati alla Medicina, 19 (3°s.) :173-177; Polli Giovanni, 1865, Sull’antidoto dell’haschisch, Annali di Chimica Applicati alla Medicina, 40 (3°s.) :343-345.
POLLI GIOVANNI, 1860, Risultato di un esperimento terapeutico dell’haschisch nell’idrofobia, Annali di Chimica Applicati alla Medicina, vol. 31 (3°s.), pp. 366-371
DORVAULT, CARLO ERBA & GIOVANNI POLLI, 1849, Dell’haschisch e delle sue preparazioni, Annali di Chimica Applicati alla Medicina, vol. 8 (3°s.), pp. 83-97. -
BUONACCORSI GIOVANNI, 1851, Dell’Hashish o estratto alcoolico del seme e del fiore della Canape d’India dato per uso interno nell’epilessia ed in varie forme di nevrosi.
VERGA ANDREA, 1848, Sull’haschisch, Annali Universali di Medicina, 127:423-425; Verga Andrea, 1848, Diversi preparati di haschisch, Gazzetta Medica Lombarda, 2° s., 1:79; Verga Andrea, 1863, Lipemania guarita coll’haschisch, Gazzetta Medica Italo-Lombarda, 32 (5° s.), 2°:275. -
VALIERI RAFFAELE, 1875, Contribuzione alla terapeutica del gozzo esoftalmico, La Clinica (Napoli), 2(15):118-120;
VALIERI RAFFAELE, 1888, Sul gozzo esoftalmico curato e guarito dalla sola Canapa e suoi preparati, Napoli, Tip. dell’Unione, 64 pp. -
GREGOR G., 1853, Dell’haschisch nei parti, Annali di Chimica Applicati alla Medicina, vol. 17 (3°s.), pp. 175-176.
Vengono così scientificamente definite le caratteristiche della pianta e dei suoi principi attivi, la sua formulazione e i dosaggi terapeutici per varie patologie, ponendo le basi per l'ingresso della Cannabis nella Farmacopea Italiana ed internazionale.
Il Proibizionismo Moderno
Dopo questi millenni di gloriosa e fruttuosa storia, è proprio il ‘900 il secolo in cui la canapa conosce uno dei suoi periodi più oscuri. Da questo punto in poi, tuttavia, una serie di circostanze storico - politiche convergenti porto' un generale mutamento del clima intorno alla cannabis. L'improvvisa comparsa di alcune piantagioni in Texas e nella zona di New Orleans e soprattutto l'uso che ne facevano immigrati soprattutto messicani, ma anche musicisti jazz e giovani viaggiatori fa nascere improvvisamente il "pericolo marijuana".
A partire dal 1910, i bollettini della Commissione per la Sanita' Pubblica di New Orleans scrivevano ripetutamente che la "marijuana e' la piu' pericolosa sostanza mai apparsa nella zona ed i suoi nefasti effetti possono trasformare i buoni uomini bianchi in neri e cattivi". Nella sola cittadina di Storeyville, luogo di nascita di Louis Armstrong e centro vitale della cultura jazz, si contavano "oltre 200 consumatori abituali".
Con questo tipo d'informazione, venne montata un'ossessiva campagna stampa che porto' nel 1915 al bando di uso e possesso di marijuana a El Paso (Texas), Utah e California, seguiti
da altri 14 stati entro il 1929.
Per la prima volta la stampa nazionale si occupò della questione, diffondendo le allarmanti notizie fornite dall'appena fondato Federal Bureau of Narcotics (FBN) nel 1930. Harry Anslinger,
neodirettore, iniziò la schedatura di decine di musicisti jazz di colore, fornendo al Congresso regolari relazioni sui pericoli della diffusione dell'uso di cannabis, rea di provocare "musica
satanica" e "rapporti sessuali tra donne bianche, negri e messicani".
Tuttavia il primo paese ad imporre leggi proibizioniste fu l'Egitto, dove la coltivazione venne proibita fin dal 1879, come riporta Ahmad M. Khalifa (in V. Rubin, Cannabis and Culture,1975). In Grecia l'uso fu proibito fin dal 1890 con la motivazione che "la cannabis e' causa di pazzia". E lo stesso avvenne nel 1913 in Giamaica, seguita nel 1928 dal Sudafrica.
Il Military Investigation Commitee del Canale di Panama pubblico' due rapporti (1925 e 1931) dove si dichiarava che "....la marijuana non costituisce alcun problema per soldati e civili della zona, e nessun provvedimento restrittivo si rende quindi necessario."
Già nel 1925 viene siglato il “Second Internetional Opium conference” di Ginevra da parte della “Lega delle Nazioni”, con cui viene circoscritto l'utilizzo della canapa se non per motivi scientifico terapeutici. In Italia, la fiorente coltivazione dei primi anni del 900 subisce un freno con l'entrata in vigore della legge Mussolini-Oviglio del 1923 che vieta la coltivazione della Cannabis Indica.
Negli Stati Uniti nel 1930 l'estratto di Cannabis è ancora riconosciuto come terapia nella US Pharmacopeia.
Tuttavia è proprio nel continente americano che il 14 Giugno 1937, per un insieme di motivi estranei alla scienza e alla pratica medica, e, nonostante la ferma opposizione dell'American Medical Associacion, il Presidente Roosevelt firmò il “Marijuana Tax Act”, emanato dal Congresso degli Stati Uniti d'America, che di fatto impediva la coltivazione di qualsiasi tipo di canapa, anche a scopo medicamentoso. La legge non vietava espressamente il consumo, la compravendita o la coltivazione della specie, ma di fatto rendeva economicamente improponibile l'utilizzo della Cannabis in quanto prevedeva delle tasse elevate su qualsiasi tipo di transazione commerciale riguardante la pianta o derivati di essa.
Inizia il proibizionismo commerciale.
Allo stesso modo nel 1938 la coltivazione di Cannabis divenne illegale in Canada sotto la Legge sulle droghe e stupefacenti (Small and Marcus, 2002).
La Cannabis esce dalle Farmacopee Statunitense prima del Primo Conflitto Mondiale.
Il termine “Marijuana” o “Marihuana”, nella accezione di narcotico, stupefacente illegale, sostituisce quasi completamente la parola Cannabis nel linguaggio comune.
Si conclude la fase di Dispersione secondaria della Canapa nel pianeta.
Inizia la fase V, la prima fase della Dispersione Terziaria che comprende gli anni dal dopoguerra algi anni 90.
Nel 1961 la “Single Convention on Narcotic Drugs”, resa effettiva nel 1964, e ratificata da 40 paesi, si propose di allargare il controllo, riservato dai primi accordi solo a oppio, coca e loro derivati, anche alla cannabis e ai composti con effetti simili. Codificò tutti i trattati multilaterali già esistenti sul controllo delle droghe, e il principale obiettivo fu di limitare il possesso, l’uso, il commercio, l’importazione, l’esportazione e la produzione delle sostanze stupefacenti esclusivamente a scopi medici e scientifici. La convenzione istituì anche la International Narcotics Control Board (INCB), che incorporava gli organismi Permanent Central Board e Drug Supervisory Board.
Inizia il Proibizionismo moderno.
Per più di un ventennio la Cannabis verrà demonizzata come sostanza pericolosa e d'abuso, contro la quale vale investire più risorse ed energie possibili per debellarla.
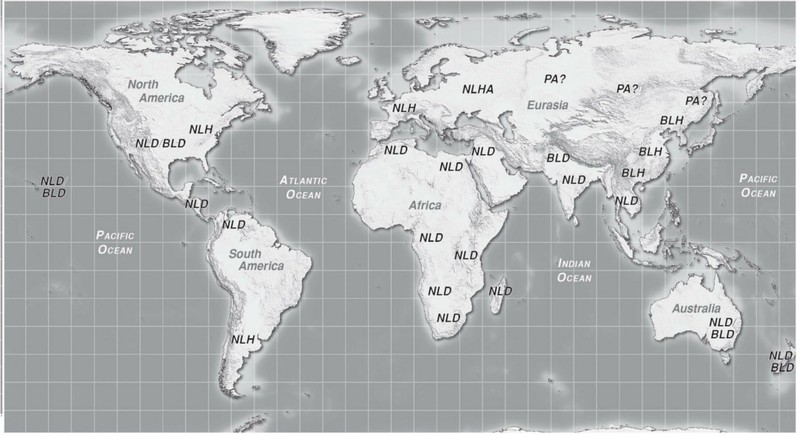
Da qui in poi, nella fase della dispersione terziaria, la cultura Cannabica diventa una “cosa proibita”, l'interesse e la passione di alcuni coltivatori sparsi in tutto il pianeta, nonostante la proibizione delle leggi, mantennero in vita le preziose genetiche “da droga”, in maniera amatoriale, nascosta, in un movimento underground. Inizia un periodo di drastica separazione tra l'ambiente medico scientifico, da quello ludico-ricreativo, o religioso tradizionale.
Anche dal punto di vista della Dispersione della cannabis nel pianeta, si assiste ad una netta separazione delle varietà da fibra, che pur in netto declino rispetto al passato, continuano ad essere coltivate, e le varietà da droga che diventano sompletamente illegali.
La tecnologia e il progresso tecnico vedono però proprio in questi anni lo sviluppo delle lampade a scarica, che con un efficienza luminosa migliore rispetto alle lampade tradizionali ad incandescenza, permettevano la coltivazione in ambienti artificiali.
Nascono le prime coltivazioni al chiuso, per sfuggire al controllo delle autorità.
E' un momento importante per la dispersione della Cannabis, in quanto diventa improvvisamente possibile coltivare in qulunque angolo del pianeta raggiunto da energia elettrica, in qualunque periodo dell'anno.
L'introduzione delle varietà afghane di tipo BLD, a foglia larga, di bassa statura e dalla maturazione precoce, più facili da crescere in ambienti artificiali favorì il diffondersi della tecnica.
La riscoperta della Cannabis Medicinale ad Oggi
L'interesse medico per la Cannabis si risveglia all'inizio degli anni settanta del secolo scorso, in seguito alla scoperta del Cannabidiolo (CBD), nel 1964 da parte del team coordinato da Raphael Mechoulam, professore di chimica alla Università Ebraica di Gerusalemme, membro dell'Istituto Weizmann, e successivamente del ∆-9 tetraidrocannabinolo (THC), il principale componente psicoattivo della Cannabis.
In questi anni, Lester Grinspoon, professore di psichiatria all’Università di Harvard, ebbe forse il ruolo principale nel processo di reintroduzione della Cannabis in medicina. Nel 1967 il Prof. Grinspoon dedicò un anno sabbatico alla ricerca sulla Cannabis. Il suo scopo originario era di supportare scientificamente la diffusa preoccupazione per il crescente uso di Cannabis da parte dei giovani. Lo studio della letteratura scientifica lo convinse che la posizione ufficiale e, di conseguenza il giudizio popolare, erano viziati alla base da pessime informazioni, se non da vere e proprie bugie e manipolazioni. Così nel 1971 pubblicò il risultato delle sue ricerche in un libro, “Marihuana reconsidered”, che ancora oggi può essere considerato la migliore e più esauriente introduzione sull’argomento.
Ed è proprio nel 1971 che nella Conferenza sulle Droghe delle Nazioni Unite che si riconosce l'importanza fondamentale di alcune sostanze classificate come narcotici e proibite, anche per un valore medicinale terapeutico.
Si legge:
“Convenzione sulle sostanze psicotrope
(stipulata a Vienna il 21 febbraio 1971)
PREAMBOLO
Le Parti :
-Pensose della salute fisica e morale dell'umanità,
-Preoccupate del problema della salute pubblica e del problema sociale che sorgono dall'abuso di alcune sostanze psicotrope,
-Determinate a prevenire ed a combattere l'abuso di tali sostanze e il traffico illecito che ne consegue,
-Riconoscendo che l'utilizzazione delle sostanze psicotrope a fini medici e scientifici è indispensabile e che la possibilità di procurarsi queste sostanze a tale fine non dovrebbe essere oggetto di alcuna restrizione ingiustificata [...]”
Due anni dopo l'uscita di "Marijuana reconsidered", nel 1973, il dott. Tod H. Mikuriya pubblicò il primo libro a nostra conoscenza specificamente dedicato agli usi medici della Cannabis. Si tratta di una voluminosa raccolta di articoli scientifici pubblicati fra il 1839 e il 1972.
Nel 1976 in seguito alla assoluzione dopo il processo di Robert C. Randall, il primo paziente della Storia che utilizzasse Canapa terapeutica per lenire il glaucoma, venne istituito il “Compassionate Investigational New Drug program”, o “Compassionate IND”, per fornire droga vegetale prodotta presso l'Università del Missisippi.
Nel 1978 la Investigational New Drug Application Society forniva Canapa a sette pazienti durante il programma chiamato “Compassionate use Program”, sospeso poi nel 1991. Ad oggi rimangono solo 4 pazienti, che ancora ricevono la terapia.
A queste prime opere se ne affiancarono, negli anni successivi, molte altre. Tra queste in particolare ricordiamo il famoso rapporto dell'Institute of Medicine dell'Accademia Nazionale delle Scienze (1982) che dedica un ampio capitolo a "Potenziale terapeutico e usi medici della marijuana".
Negli anni successivi saranno pubblicate altre opere dedicate ai potenziali terapeutici e agli usi medici della Cannabis, e a partire dal 1985 viene sviluppato e commercializzato negli USA il primo cannabinoide di sintesi, il Dronabinol, ad azione agonista del THC, cui segue poi l'equivalente Nabilone in Gran Bretagna (Herkenham, 1986).
Infine, negli anni '90, numerosi libri aprono la strada ai nuovi movimenti di base impegnati per la riconquista del diritto alla "marijuana come medicina". Da segnalare la nuova fondamentale opera di L. Grinspoon e J.B. Bakalar sugli usi medici della Cannabis: "Marijuana - the forbidden medicine"; l'importante "Marijuana myths, marijuana facts" di Lynn Zimmer e John P. Morgan.
Nel 1990 vengono scoperti i recettori dei cannabinoidi da parte di Herkenham.
Nel 1996 nello stato della California viene sancita per la prima volta, tramite un referendum, la liceità dell'uso terapeutico.
A livello politico e normativo una svolta si ebbe nel 1997, dopo la pubblicazione degli studi del British Medical Association che individuò alcune possibili aree terapeutiche specifiche, dopo la rassegna di tutti gli studi medico-clinici sul tema.
Il 5 novembre del 1998: gli elettori americani di Alaska, Arizona, Colorado, Nevada, Oregon e Washington, consultati con un referendum su questo tema, approvano l'uso terapeutico della marijuana per i malati di tumore e di AIDS. E in analoga direzione va un recente provvedimento legislativo dello stato delle Hawaii.
Qualche giorno dopo, in Europa, lo Science and Technology Committee della Camera dei Lord britannica pubblica un rapporto che, sollecitando una modifica della legge attualmente in vigore, promuove l'uso terapeutico dei derivati della cannabis.
E a distanza di pochi mesi viene pubblicato un nuovo rapporto dell'Institute of Medicine della National Academy of Sciences USA "Marijuana and Medicine: Assessing the Science Base", che formula analoghe raccomandazioni.
Questo ha portato, agli inizi del '99, a prese di posizione a favore dell'uso medico dei cannabinoidi da parte del Governo israeliano, dell' International Narcotic Control Board dell'ONU, del Ministro della Sanità canadese, e del Ministro della Sanità tedesco.
Le Nazioni Unite riconsiderarono il THC da narcotico a sostanza psicotropa e autorizzarono il suo uso terapeutico.
Nel 2005 in Canada è stato introdotto il Sativex®, brevettato da GW Pharmaceuticals e che, grazie ad un accordo commerciale, viene distribuito sul mercato dalla Bayer; è il primo farmaco, contenente cannabinoidi ottenuti da estratti vegetali, ad essere accettato nella farmacopea ufficiale di un paese occidentale nell’ era moderna, per il sollievo da dolore neuropatico nella sclerosi multipla.
Negli ultimi anni la Cannabis nel mondo sta subendo una ulteriore rivisitazione riguardo alle sue proprietà terapeutiche che prevedono sempre maggiori campi di impiego; è consentito l’uso terapeutico in molti stati negli Usa, tra cui annoveriamo: Alaska, Arizona, Arkansas California, Canada, Colorado, Connecticut, Delaware, District of Columbia, Hawaii, Illinois, Iowa, Maine, Maryland, Massachusetts, Michigan, Minnesota, Montana, New Hampshire, Nevada, New Jersey, New Mexico, New York, Oregon, Pensylvannia, Rhode Island, Vermont, Texas, Washington, Washington DC, Winsconsin.
Dal 2014 in Colorado e nel Washington si è aperta la strada per l'uso ricreativo, ludico legale. A livello europeo l'uso medico della Cannabis è legale in alcuni paesi, tra cui Austria, Finlandia, Germania, Italia, Paesi Bassi, Portogallo, Romania e Spagna, Francia.
Pioniera l'Olanda nel 2003, fu la prima nazione a dotarsi di un Ufficio Pubblico del Ministero della Salute dedicato alla Cannabis, BMC (Bureau of Medical Cannabis) per la gestione legale della Cannabis terapeutica venduta in Olanda. Riconoscendo tra i primi le potenzilità medicinali della Cannabis, forse aiutati anche dall'apertura mentale delle leggi e dalla disponibilità della droga nei coffeshop, sono proprio i Paesi Bassi a sollevare il problema della standardizzazione del prodotto.
Pragmaticamente indicono una gara di appalto per la coltivazione e la produzione della droga, per il controllo qualità e istituiscono l'Ufficio per la Cannabis Medicinale OMC, che in ottemperanza delle regole imposte dalla Convenzione Unica sugli stupefacenti delle Nazioni Unite, gestisce e coordina tutte le operazioni e la distibuzione.
Nasce la Bedrocan BV, la prima azienda europea autorizzata a coltivare varietà medicinali di Cannabis.
Le piante, una volta coltivate in ambienti artificiali in condizioni standardizzate, sono raccolte, pulite ed essiccate.
La dorga vegetale ottenuta viene successivamente sterilizzata mediante un processo di irraggiamento con raggi gamma, confezionata, ricontrollata per la qualità e resa disponibile per il commercio. Diventa dunque disponibile per il mercato Olandese e di conseguenza europeo della prima droga vegetale stupefacente prodotta e distribuita legalmente.
Dal 2013 in Canada, dopo 10 anni di sperimentazione con il programma MMAR, delinea le prime linee guida sulla coltivazione e produzione di Cannabis per uso terapeutico di grado farmaceutico e apre il programma MMPR per l'arruolamento di produttori autorizzati per il mercato farmaceutico nazionale. In breve tempo si raccolgono le adesioni di una quindicina di produttori autorizzati dal governo Canadese, che coltivano e distribuiscono droga vegetale di differenti varietà ai pazienti dotati di ricetta medica.
L'esperienza maturata in un decannio, pone le basi per continuare la distribuzione attraverso i canali dei 'caregiver', senza passare necessariamente dalle farmacie, trattando la cannabis medicinale come droga vegetale, non come farmaco formulato. In breve tempo il Canada diventa il leader della produzione e coltivazione legale della cannabis terapeutica, prevedendo per il 2015 un fabbisogno annuale di circa 55 tonnellate di droga vegetale.
La situazione in Italia è, come al solito, molto complessa.
Negli ultimi anni si è assistito ad uno sviluppo vorticoso delle leggi in materia.
Con il tardivo recepimento della Conferenza delle Nazioni Unite del 1961, l'Italia promuove una legge molto restrittiva sugli stupefacenti nel 1964, ritoccata nel 22 dicembre 1975, che rimane immodificata sino alla sua revisione, tradotta nel d.pr 309/90, tuttora in vigore.
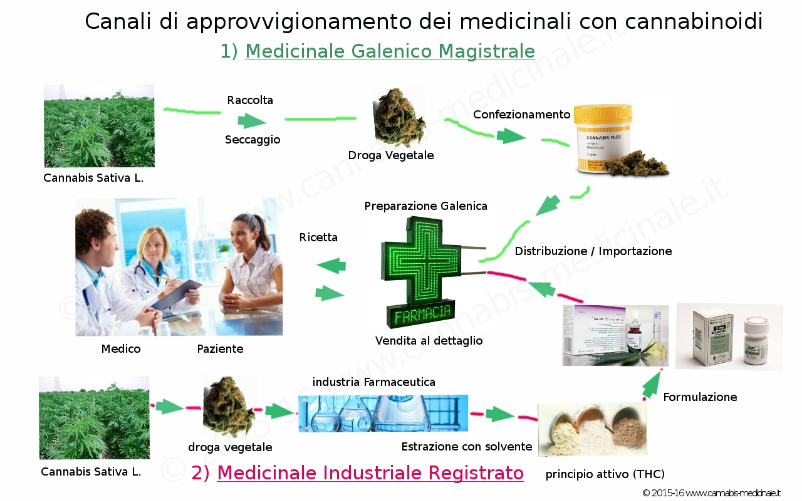
L’unica maniera di ottenere legalmente i cannabinoidi è rappresentata dalla complessa procedura prevista dal D.M. 11-2-1997 (Importazione di specialità medicinali registrate all’estero) e inizialmente era legate esclusivamente alle specialità medicinali registrate negli altri paesi.
Dobbiamo attendere sino al 8 aprile 1998 con l'approvazione della cosiddetta Legge Di Bella n.94/98, con cui si regolamentano le formulazioni galeniche magistrali e officinali.
La legge infatti, in linea con le altre nazioni europee, permette e regolamenta la prescrizione di formulazioni galeniche o magistrali estemporanee, personalizzate da paziente a paziente, e fornite caso per caso dalla farmacia dietro ricetta medica.
All'epoca non era diponibile al mondo però alcuna droga vegetale standardizzata e prodotta per il mercato farmaceutico, da usarsi come materia prima per la preparazione magistrale o galenica. Rimanevano a disposizione per il mercato le preparazioni industriali Marinol e Cesamet.
La prima richiesta di importazione di cannabinoidi sul territorio italiano risale all’agosto 2002, su prescrizione del prof. Andrea Pelliccia. Dopo questa prima importazione “pionieristica” il canale individuato è stato ulteriormente perfezionato a favore di alcuni pazienti affetti da sclerosi multipla. L’entusiasmo per essere riusciti a mettere a punto un canale di approvvigionamento legale viene tuttavia ridimensionato dal fatto di dover fare i conti con l’alto costo della terapia e dal variabile intervento delle ASL delle varie Regioni a sostenere questo costo.
Nel 2003 l'OMC olandese inizia la distribuzione alle farmacie della droga vegetale per uso medicinale.
Tuttavia intanto in Italia, l’approvazione, in chiusura della XIV Legislatura, della cosiddetta “legge Giovanardi Fini” (Legge 21 febbraio 2006 n. 49 pubblicata nella G.U. del 27.02.2006) ha classificato arbitrariamente la Cannabis e i suoi derivati tra le sostanze di abuso “ prive di utilità terapeutica” (Tabella I). Per fortuna, quasi a rimediare in corner per lo scempio legislativo, sempre nello stesso anno, il 18 luglio il Ministro della Saluto On. Livia Turco emana un'ordinanza per auorizzare "l'importazione di medicinali a base di delta 9 tetraidrocannabinolo per la somministrazione, a scopo terapeutico, in mancanza di alternative terapeutiche, in pazienti che necessitano di tali medicinali".
Si deve attendere sino al 2013, anno in cui anche l'Italia, sotto spinta delle pressioni comunitarie, accetta la possibilità di utilizzare cannabinoidi come terapia. Nel pioneristico decreto dell' On.Balduzzi (ultimo medico nominato come Ministro della Salute) del febbraio 2013, quasi in sordina, si inseriscono le Preparazioni a base di Cannabis in Tabella 2 dei Medicinali Stupefacenti. E' una data storica per la Cannabis medicinale in Italia.
Poche persone, tra cui molti politici, non avranno di certo compreso la portata del passaggio da una sezione all'altra delle tabelle degli stupefecenti per la cannabis. In un sol colpo si aprivano le porte alla importazione della droga vegetale per le farmacie per il mercato magistrale e galenico, si creava la possibilità industriale di poter coltivare, produrre, trasformare e commerciare la cannabis medicinale e fornirla al paziente.
Poco dopo, nel luglio 2013 il Sativex®, entra nel prontuario farmaceutico come farmaco industriale e su larga scala, dotato di AIC, a prescrizione limitata e approvato per i soli spasmi resistenti alla terapia convenzionale nella Sclerosi Multipla.
Risultano quindi disponibili in Italia attualmente diverse opzioni terapeutiche, indirizzate a patologie diverse e con peculiari e specifici processi prescrittivi e burocratici.
- il canale "storico" dei medicamenti, cioè quello galenico magistrale o officinale, in cui una terapia specifica, personalizzata ed estemporanea viene formulata e personalizzata negli ingredienti e nelle dosi dal medico per un singolo paziente, preparata specificamente da parte del farmacista preparatore e utilizzata sotto responsabilità del medico e del paziente. Qualunque medico può prescrivere una ricetta magistrale non ripetibile, su carta bianca osservando certe norme prescrittive particolari. La prescrizione segue le direttive della legge 97/98 e può rigurdare qualunque patologia per cui la scienza riconosca un effetto terapeutico documentato e descritto.
- il canale "classico" del farmaco, cioè quello industriale, su larga scala, dei farmaci formulati e dotati di AIC (Autorizzazione all'Immissione in Commercio) rilasciata dall' AIFA, a cui appartiene per il mercato Italiano, attualmente solo il Sativex® della GW Pharma, approvato per gli spasmi resistenti alla terapia convenzionale nella sclerosi multipla, prescrivibile con ricetta non ripetibile e limitata solamente da parte di un medico specialista in neurologia. Permangono prescrivibili tramite la procedura di importazione dall'estero le specialità medicinali, che comunque appartengono a questa categoria, Marinol®(dronabinol), disponibile in Olanda, germania, Stati Uniti, e il Cesamet® (nabilone) disponibile nel regno Unito e in Canada, aprovati per il trattameno della nausea e del vomito in soggetti sottoposti a chemioterapie antitumorali e come stimolante l'appetito per il trattamento dell'anoressia in pazienti affetti da AIDS.
A voler complicare le cose, come al solito, (siamo in Italia), probabilmente per motivi più politico elettoriali, basati su antichi pregiudizi, più che su fatti e dati scientifici, in questo panorama di ritrovato entusiasmo, il Ministero della Salute, che naturalmente si trova al centro della gestione di tutte le autorizzazioni necessarie riferite alla Cannabis Medicinale e già regolamentate nei dettagli dal d.pr 309/90, inizia una politica di chiusura a riccio nei confronti di tutti gli attori potenzialmente coinvolti nel nuovo mercato nascente in Italia, e per scelta non vengono concesse ulteriori autorizzazioni
riguardo la cannabis. Nel febbraio 2014, con la sentenza n. 32 la Corte Costituzionale dichiara l'illegittimità costituzionale, per violazione dell'art. 77, secondo comma, Cost., che regola la procedura di conversione dei decreti-legge, degli artt. 4-bis e 4-vicies ter del d.l. 30 dicembre 2005, n. 272 (intitolato “Misure urgenti per garantire la sicurezza ed i finanziamenti per le prossime Olimpiadi invernali, nonché la funzionalità dell'Amministrazione dell'interno. Disposizioni per favorire il recupero di tossicodipendenti recidivi”), come convertito con modificazioni dall'art. 1 della legge 21 febbraio 2006, n. 49, così rimuovendo le modifiche apportate con le norme dichiarate illegittime agli articoli 73, 13 e 14 deld.P.R. 9 ottobre 1990, n. 309 (Testo unico in materia di stupefacenti).
Nel settembre 2014 viene deciso, con un accordo tra i Ministeri della Salute e della Difesa che, per soddisfare il bisogno sempre più cresente di prodotto vegetale che può solo essere importanto dall'estero con grandi costi per l'utenza, sarà incaricato i'Istituto Farmaceutico Militare di Firenze per la coltivazione delle piante destinate al mercato farmaceutico e la produzione dei principi attivi per la formulazione di preparazioni a base di cannabinoidi.
Con la scusa di associare la capacità produttiva farmaceutica degli impianti dello Stabilimento Militare, alla sicurezza, data dalla sorveglianza armata dell'istituto.
Con un colpo di mano il Ministero crea un monopolio di fatto che chiude completamente il sistema produttivo farmaceutico e la filiera Italiana della cannabis terapeutica, accentrando tutte le responsabilità, gli oneri e onori in pratica all'Istituto Farmaceutico Militare di Firenze.
Normalmente uno stato civile e moderno, così come accedde ad esempio in Olanda, avrebbe indetto una gara di appalto pubblico, rivolto a produttori farmaceutici autorizzati, che sarebbero stati in grado di fornire un prodotto standardizzato, dopo adeguata prassi di R&D, senza costi aggiuntivi pubblici e in un normale mercato di libera concorrenza si sarebbe arrivati in breve tempo ad avere qualità di prodotto ad un prezzo inferiore.
Invece, solo nel caso specifico della Cannabis ad uso farmaceutico, in totale contrasto alle norme consuete del mercato farmaceutico, lo stato si inbarca direttamente in un'impresa industriale senza alcuna conoscenza, esperienza o garanzia in mano, investendo una cospicua dose di capitali e risorse pubbliche, in regime di monopolio, rischiando solo una misera figura, inseguendo un "affare" che pare vantaggioso più per le casse dello stato, in prospettiva di speculazione sulla posizione dominante di monopolista, più che per i pazienti che richiedono garanzie di qualità in tempi brevi.
Si deve infatti attendere ben più di un anno, sino al dicembre 2015, per conoscere i dettagli dell'ambizioso progetto ministeriale e comprenderne appieno i numerosi punti di debolezza.
Il 9 novembre 2015 (con decorrenza dicembre 2015) viene pubblicato in Gazzetta Ufficiale il Decreto Ministeriale che crea anche per l'Italia un ufficio di controllo per la Cannabis medicinale simile all' OMC olandese, in ottemperanza dell'art. 21 e 23 della Convenzione Unica sulle sostanze stupefacenti del 1961, che prevede appunto l'istituzione di un organismo di controllo statale, colmando tralaltro un esigenza prevista con un ritardo di più di 50 anni...
Il Ministero della Salute, nel decreto, approfitta per inserire una serie di nuove norme speciali e uniche per il mercato farmaceutico della Cannabis.
In una presa di posizione unica nel suo genere, il Ministero produce un documento che assomiglia di fatto ad un foglietto illustrativo di un formulato industriale, con norme speciali sulla filiera produttiva della cannabis, pesanti limitazioni normative, che di fatto assicurano più il monopolio della produzione statale, piuttosto che garantire una produzione autorizzata volta alla qualità del prodotto in tempi brevi.
Il risultato concreto che gli operatori del settore toccano con mano è una assurda complicazione delle procedure burocratiche, con l'introduzione di nuove carte, nuovi passaggi, senza che venisse risolto il problema dell'approvvigionamento in tempi brevi e a costi ragionevoli della materia prima.
Per mantenere la propria posizione di monopolio, il Ministero della Salute mescola abilmente le carte nel decreto, confondendo, per le richieste e i permessi autorizzativi, i due canali distinti attraverso cui un vengono prescritti Cannabinoidi ai pazienti. La via della formula magistrale galenica, personalizzata, estemporanea e su misura paziente per paziente, che segue precise regole (che di fatto è la via più utilizzata attualmente in Italia sia come volume di vendita che per numero di prescrizioni), viene confusa e sovrapposta con la via industriale e su larga scala dei farmaci immessi in commercio.
Per la Cannabis, e solo unicamente in questo caso nella storia della farmaceutica e della farmaognosia, la droga vegetale, definita come "parte della pianta dove si concentra la maggior parte del principio attivo", viene erroneamente e abilmente confusa come "principio attivo" (sostanza pura, estratta tramite solvente o sintetizzata chimicamente, dotata delle attività farmacologiche). E come dire che il chicco del caffè è la caffeina, o il papavero da oppio è la morfina, o il salice è l'aspirina, la foglia del tè è la teina, ecc...
Nella Cannabis la droga vegetale è l'infiorescenza femminile non impollinata ed essiccata.
Nessun processo di estrazione con solventi o sintesi chimica.
Per la cannabis inoltre, non ha molto senso parlare di un principio attivo, quanto più di fitocomplesso.
Nei tricomi ghiandolari la pianta produce più di 600 sostanze diverse, compresi i principi attivi di interesse per l'Ufficio centrale degli Stupefacenti (il delta 9 THC e il delta 8 THC), che tutti insieme, con un effetto "enturage", concorrono all'effetto terapeutico e medicinale della cannabis. E' dimostrato che il fitocomplesso intero può essere più efficace con meno effetti collaterali, rispetto alla formulazione di puri principi attivi isolati.
Se apparentemente il confine può sembrare sottile, a livello della normativa farmaceutica, la differenza nelle diverse strutture ed impianti che servono per produrre una droga vegetale o un principio attivo e molto ampia.
Un' azienda agricola che produce piante officinali, solitamente produce droghe vegetali, anche eventualmente stupefacenti, un'officina farmaceutica produrrà successivamente un farmaco, estraendo principi attivi, formulando una forma farmaceutica (compresse, fiale, spray, supposte. cerotti..) e fabbricandola per via industriale su larga scala.
Le autorizzazioni sono molto diverse e ovviamente molto più complesse per un'officina farmaceutica.
In Italia manca, di fatto la droga vegetale che il farmacista dispensa ai pazienti con ricetta medica, non un farmaco creato attraverso un estrazione di THC. Per quello abbiamo già a disposizione il Marinol, o il Sativex.
Se, ad un osservatore poco attento, l'intenzione potrebbe apparire nobile, di fatto, introducendo nuove richieste autorizzative che coinvolgono ulteriori Enti statali come il Ministero delle Politiche Agricole, le Asl le regioni e AIFA, il Ministero si garantisce ulteriori 24 mesi di monopolio nelle sperimentazioni, prima di poter fornire il mercato farmaceutico. Il sistema risulta paralizzato dalle autorizzazioni necessarie alla produzione, che il Ministero, nel doppio ruolo di committente e di controllore di se stesso, non concede ad altri soggetti, anche se in possesso dei necessari requisiti.
Il timore di tutti è che allo scadere dei 23 mesi ci si trovi davanti ad un ennesimo rinvio...
Attualmente dunque rimangono possibili in Italia tuttora i due canali di approvvigionamento, ognuno ben distinto e caratterizzato per indicazioni, posologia, prescrivibilità, rimborsabilità e prezzo, perdurando comunque la necessità e l'obbligo di importazione dall' estero di tutti i farmaci contenenti cannabinoidi, sia quelli sotto forma di droga vegetale, sia come formulati industriali.
Ci si augura che il Ministero contatti degli esperti in materia informati, che li aiutino ad uscire da questo imbarazzante empasse, che però di fatto danneggia i pazienti che necessitano e hanno diritto ad una terapia, spesso indispensabile, a costi adeguati.
Volete saperne di più?
Gli articoli sono tratti dalla tesi di specializzazione di II livello del Dott. Lorenzo Calvi, “Dalla preistoria alla Farmacopea Moderna Storia dell'uso medicinale e terapeutico della Cannabis sativa L. Validazione e standardizzazione dei metodi analitici della droga vegetale ad uso medicinale e terapeutico umano, armonizzazione delle Linee guida internazionali per il reinserimento della Cannabis sativa L. in Farmacopea ufficiale.” 2015, Master Etnobiofarmacia e prodotti naturali della biodiversità.
Università degli Studi di Pavia.
Tutti i diritti riservati.
Bibliografia
-
ABEL E.L.(1980): “Marihuana:The First Twelve Thousand Years” Plenium Press, New York, Pg.100.
-
ADAMS TB, Taylor SV (2010). “Safety evaluation of essential oils: a constituent-based approach” baser KHC, Buchbauer G (eds). Handbook of Essential Oils: Science, Technology.
-
APPENDINO G, GIBBONS S, GIANA A, PAGANI A, GRASSI G, STAVRI M et al. (2008). “Antibacterial cannabinoids from Cannabis sativa: a structure-activity study” J Nat Prod 71: 1427–1430 Applications. CRC Press: Boca Raton, FL, pp. 185–208
-
AMADUCCI S., ERRANI M., VENTURI G. (2002): Response of hemp to plant population and nitrogen fertilisation. Italian Journal of Agronomy, 6, 2:103-111.
-
ARNHOLD T, ELMAZAR MM, NAU H (2002). “Prevention of vitamin A teratogenesis by phytol or phytanic acid results from reducedmetabolism of retinol to the teratogenic metabolite,all-trans-
-
ARNAO G., 1977, Uso di cannabis come decondizionamento culturale, in: A. Vermiglione (cur.), La follia. Documenti del Congresso Internazionale di Psicanalisi, Milano 1-4 dicembre 1976, Feltrinelli, Milano, pp. 215-227.
-
ARPINO P., 1909, Haschish, Cannabis indica. Notizie storiche, chimiche, fisiologiche, terapeutiche, Unione Tipografico-Editrice Torinese, Torino, 46p
-
ASSOCIAZIONE CANNABIS TERAPEUTICA (ACT) (2002): “Erba Medica. Usi terapeutici della Cannabis”. Nuovi Equilibri, Viterbo, Pg. 203.
-
BAEK SH, KIM YO, KWAG JS, CHOI KE, JUNG WY, HAN DS (1998). “Boron trifluoride etherate on silica-A modified Lewis acid reagent (VII). Antitumor activity of cannabigerol against human oral epitheloid carcinoma cells” Arch Pharm Res 21: 353–356
-
BANERJEE SP, SNYDER SH, MECHOULAM R (1975). “Cannabinoids: influence on neurotransmitter uptake in rat brain synaptosomes” J Pharmacol Exp Ther 194: 74–81
-
BANG MH, Choi SY, Jang TO, Kim SK, Kwon OS, Kang TC et al. (2002). “Phytol, SSADH inhibitory diterpenoid of Lactuca sativa” Arch Pharm Res 25: 643–646
-
BASILE AC, Sertie JA, Freitas PC, Zanini AC (1988). “Anti-inflammatory activity of oleoresin from Brazilian Copaifera”.
-
BATTAGLIA B., 1887, Sul Hashish et sua azione nell’organismo umano, Psichiatria (Napoli), vol. 5, pp. 1-38.
-
BAZZAZ F.A., DUSEK D., SEIGLER D.S. E HANEY A.W. (1975): Photosynthesis and cannabinoid content of temperate and tropical populations of Cannabis sativa L. Biochemical Systematics and Ecology, 3: 15-18.
-
BAZZI M., 1940, Dosaggio biologico della Cannabis indica coltivata nei dintorni di Pavia, Bollettino Società Italiana Biologia Sperimentale, vol. 15, pp. 858-860.
-
BAZZI M., 1941, Cannabis indica, Milano, Inverni della Beffa, 64 pp.
-
BERENBAUM MC (1989). “What is synergy?” Pharmacol Rev 41: 93–141 Howlett AC (1987). “Cannabinoid inhibition of adenylate cyclase: relative activity of constituents and metabolites of marihuana” Neuropharmacol 26: 507–512
-
BEYER E.M. (1976): A potent inhibitor of ethylene action in plants. Plant Physiology, 58: 268-271.
-
BIRD K.D., BOLEYN T., CHESHER G.B., JACKSON D.M., STARMER G.A. E TEO R.K.C. (1980): Inter-cannabinoid and cannabinoid-ethanol interactions and their effects on human performance. Psychopharmacology, 71: 181-188.
-
BICKERS D, CALOW P, GREIMT H, Hanifin JM, Rogers AE, Saurat JH et al. (2003). “A toxicologic and dermatologic assessment of linalool and related esters when used as fragrance ingredients” Food Chem Toxicol 41: 919–942
-
BISOGNO T, HANUS L, DE PETROCELLIS L, TCHILIBON S, PONDE DE, BRANDI I et al. (2001). “Molecular targets for cannabidiol and its synthetic analogues: effect on vanilloid VR1 receptors and on the cellular uptake and enzymatic hydrolysis of anandamide” Br JPharmacol 134: 845–852
-
BINET L, BINET P, MIOCQUE M, ROUX M, BERNIER A (1972). “Recherches sur les proprietes pharmcodynamiques (action sedative et action spasmolytique) de quelques alcools terpeniques aliphatiques” Ann Pharm Fr 30: 611–616 Bòcsa I. (1961): Data on the seed-yelding capacity of the unisexual F1- Hybrid hemp. Novènitermelès, 10: 43-50.
-
BISSET NG, Wichtl M (2004). “Herbal Drugs and Phytopharmaceuticals: A Handbook for Practice on A Scientific Basis” , 3rd edn. Medpharm Scientific Publishers: Stuttgart; CRC Press: Boca Raton, FL
-
BÒCSA I., MATHÈ P. E HANGYEL L. (1997) : Effect of Nitrogen on tetrahydrocannabinol (THC) content in hemp (Cannabis sativa L.) leaves at different positions. Journal of the International Hemp Association, 4: 80-81.
-
BÓCSA I. E KARUS M. (1998): “The cultivation of hemp: botany, varieties, cultivation and harvesting”. Hemptech, Sebastopol, California, Pg. 184.
-
BÒCSA I., FINTA-KORPELOVA Z., NAGY I., HESZKY E., TORJÈK O., BUCHERNA N., KISS E. E HOMOKI H. (2002): Novel male-specific molecular markers (MADC5, MADC6) in hemp. Euphytica, 127: 209-218.
-
BORNHEIM L.M., BORYS H.K. E KARLER R. (1981): Effects of cannabidiol on citochrome P-450 and hexobarbital sleep time. Biochemical Pharmacology, 30 (5): 663-670.
-
BOUCHER F., COSSON L., UNGER J. E PARIS M.R. (1974): Le Cannabis sativa L. ; races chimiques ou varietes. Pl. Med. Phytotherap., 8: 20-31.
-
BOUQUET J. (1950): Cannabis. UN Bulletin on Narcotics, 2: 14- 30.
-
BOUCHARDAT & CORRIGAN, 1847, Dell’hachisch, Annali di Chimica Applicati alla Medicina, vol. 4 (3°s.), pp. 201-204.
-
BOWLES PAUL & MOHAMMED MRABET, 1975, M’hashish. Cento cammelli nel cortile (Racconti della tradizione popolare marocchina), con un’introduzione di Gianni De Martino, Arcana Editrice, Roma.
-
BOLOGNINI D, COSTA B, MAIONE S, COMELLI F, MARINI P, DI MARZO V et al. (2010). “The plant cannabinoid Delta9-tetrahydrocannabivarin can decrease signs of inflammation and inflammatory pain in mice” Br J Pharmacol 160: 677–687
-
BUONACCORSI GIOVANNI, 1851, Dell’Hashish o estratto alcoolico del seme e del fiore della Canape d’India dato per uso interno nell’epilessia ed in varie forme di nevrosi.
-
BOWLES EJ (2003). The Chemistry of Aromatherapeutic Oils, 3rd edn. Allen & Unwin: Crow’s Nest, NSW
-
BOYCE, S.S. 1900. Hemp (Cannabis sativa). A practical treatise on the culture of hemp for seed and fiber with a sketch of the history and nature of the hemp plant. Orange Judd Company, New York
-
BRAUT-BOUCHER F. (1980): Effet des conditions ecophysiologiques sur la croissance, le developpement et le contenu en cannabinoides de clones correspondant aux deux types chimiques du Cannabis sativa L. originaire d’ Afrique du Sud. Physiol. Veg., 18: 207-221.
-
BRENNEISEN R. (1984): Psychotrope Drogen II. Bestimmung der Cannabinoid in Cannabis sativa L. und in Cannabis produkten mittels Hochdruckflussigkeitschromatographie (HPLC). Pharm. Acta Helv., 59: 247-259.
-
BRENNEISEN R (2007) “Chemistry and analysis of phytocannabinoids and other Cannabis constituents” In: Elsohly M (ed.). Marijuana and the Cannabinoids. Humana Press: Totowa, NY, pp. 17–49 :
-
BRIOSI G., TOGNINI F., 1888, Contributo allo studio dell’anatomia comparata delle Cannabineae, Atti Istituto Botanico Pavia, II° s., vol. 2.
-
BRIOSI G., TOGNINI F., 1894, Intorno alla anatomia della canapa (Cannabis sativa L.). I. Organi sessuali, Atti Istituto Botanico Pavia, N.S., vol. 3, pp. 91-209.
-
BRIOSI G., TOGNINI F., 1895, Intorno alla anatomia della canapa (Cannabis sativa L.). II. Organi vegetativi, Atti Istituto Botanico Pavia, II° S., vol. 4, pp. 169-329.
-
BRUGO, 1864, Preparazione ed uso dell’olio di canape sativa: di Brugo farmacista a Romagnano, Annali di Chimica Applicata alla Medicina, vol. 39 (3°s.), pp. 249-250.
-
BRUGNATELLI L.V. Farmacopea Generale Ad Uso Degli Speziali E De Medici Moderni. Dizionario Napoli, 1808
-
BUCHBAUER G, JIROVETZ L, JAGER W, DIETRICH H, PLANK C (1991). “Aromatherapy: evidence for sedative effects of the essential oil of lavender after inhalation” Z Naturforsch [C] 46: 1067–1072
-
BUCHBAUER G., JIROVETZ L., JAGER W., PLANK C. E DIETRICH H. (1993): Fragrance compounds and essential oil with sedative effects upon inhalation. Journal of Pharmaceutical Science, 82: 660-664.
-
BURSTEIN S., LEVIN S. E VARANELLI C. (1993): Prostaglandins and Cannabis – II. Inhibition of biosynthesis by the naturally occuring cannabinoids. Biochemical Pharmacology, 22: 2905-2910.
-
BURSTEIN S., SLADE L.T. E VARANELLI C. (1995): Prostaglandins and Cannabis – III. Inhibition of biosynthesis by essential oil components of marihuana. Biochemical Pharmacology, 24: 1053-1054.
-
CALLAWAY J.C. E LAAKKONEN T.T. (1996): Cultivation of Cannabis oil seed varieties in Finland. Journal of the International Hemp Association, 3 (1): 32-34.
-
CALLAWAY J.C., TENNILLA T. E PATE D.W. (1996): Occurrence of ‘omega-3’ stearidonic acid (cis-6,9,12,15-octadecatetraenoic acid) in hemp (Cannabis sativa L.) seed. Journal of Analytical Toxicology, 21 (4): 319-320.
-
CALVI L., BRASCHI A. Curva P-V statica dei sistemi respiratori, validazione clinica di un nuovo metodo di registrazione. Tesi sperimentale di Laurea, Università di Pavia 2002 136p.;
-
CAMPBELL M. JAMES, 1893-1894, Note on the religion of Hemp, In: Report of the Indian Hemp Drugs Commission, Bombay.
-
CARLINI E.A., SANTOS M., CLAUSSEN V., BIENIEK D. E KORTE F. (1970): Stucture activity relationship of four tetrahydrocannabinols and the pharmacology acitivity of five semipurified extracts of Cannabis sativa. Psychopharmacologia, 18 (7): 82-93.
-
CARRIER EJ, AUCHAMPACH JA, HILLARD CJ (2006). “Inhibition of an equilibrative nucleoside transporter by cannabidiol: a mechanism of cannabinoid immunosuppression” Proc Natl Acad Sci USA 103: 7895–7900;
-
CASANO S. “Ottimizzazione dell’ agrotecnica della canapa (Cannabis sativa L.) per applicazioni di tipo farmaceutico”, Università degli studi di Palermo Facoltà di agraria 2004;
-
CASALONE F. (2003): “Canapicoltura Indoor”. Produzioni Shambu, Pg. 133.
-
CARVALHO-FREITAS MI, COSTA M (2002). “Anxiolytic and sedative effects of extracts and essential oil from Citrus aurantium L.” Biol Pharm Bull 25: 1629–1633
-
CASCIO MG, GAUSON LA, STEVENSON LA, ROSS RA, PERTWEE RG (2010). “Evidence that the plant cannabinoid cannabigerol is a highly potent alpha2-adrenoceptor agonist and moderately potent 5HT1Areceptor antagonist” Br J Pharmacol 159: 129–141
-
CAULFIELD, M. P. AND BROWN, D. A. (1992) “Cannabinoid receptor agonists inhibit Ca2+ current in NG108-15 neuroblastoma cells via a pertussis toxin-sensitive mechanism” Br. J. Pharmacol. 106, 231–232.
-
CAWTHORNE MA, WARGENT E, ZAIBI M, STOTT C, WRIGHT S (2007). “The CB1 antagonist, delta-9- tetrahydrocannabivarin (THCV) has antioebesity activity in dietary-induced obese (DIO) mice” Proceedings 17th Annual Symposium on the Cannabinoids. International Cannabinoid Research Society: Saint-Sauveur, QC, p. 141
-
CERADINI G., 1864, Relazione di alcuni effetti dell’haschisch provati da G.C., Annali di Chimica Applicati alla Medicina, 38 (3° s.), pp. 111-127.
-
CHANG K.C., 1969, The expansion of Chinese Neolithic culture in the central plain, Bullettin Institute Histtory Philosophy Academia Sinica, vol. 41(2), pp. 317-349.
-
CHARRIÈRE GEORGES, 1979, Crafts of the Early Eurasian Nomads, Alpine Fine Arts Collection, New York.
-
CLARKE R.C. (1981): “Marijuana Botany”. Ronin Publishing, Berkeley, Pg. 145.
-
CLARKE R.C. 2013 Evolution and ethnobotany. Berekley Univ. Of California press 434p.
-
COFFMAN C.B. E GENTER W.A. (1974): Cannabis sativa L.: Effect of time and temperature on cannabinoid profile of stored leaf tissue. UN Bullettin on Narcotics, January-March, 8: 67-70.
-
COFFMAN C.B. E GENTER W.A. (1975): Cannabinoid profile and elemental uptake of Cannabis sativa L. as influenced by soil characteristics. Agronomy Journal, 67: 491-497.
-
COFFMAN C.B. E GENTER W.A. (1977): Responses of greenhouse-grown Cannabis sativa L. to Nitrogen, Phosphorus and Potassium. Agronomy Journal, 69: 832-836.
-
COMELLI F, BETTONI I, COLLEONI M, GIAGNONI G, COSTA B (2009). “Beneficial effects of a Cannabis sativa extract treatment on diabetes-induced neuropathy and oxidative stress” Phytother Res 23: 1678–1684
-
CORVI A., “Origine delle Farmacopee ed evoluzione storica del modello e della funzione della Farmacopea” Conselve (Pd) Ed. Reg. Veneta 1993
-
COSTA B., COLLEONI M., CONTI S., PAROLARO D., FRANKE C., TROVATO A.E. E GIAGNONI G. (2004): Oral anti-inflammatory activity of cannabidiol, a non-psychoactive constituent of cannabis, in acute carrageenan-induced inflammation in the rat paw. Naunyn Schmiedebergs Arch Pharmacol., 369(3): 294-299.
-
COSTA B, TROVATO AE, COMELLI F, GIAGNONI G, COLLEONI M (2007) “The non-psychoactive cannabis constituent cannabidiol is an orally effective therapeutic agent in rat chronic inflammatory and neuropathic pain” Eur J Pharmacol 556: 75–83
-
COUTENOT, 1857, Impiego locale dell’olio di canape per sopprimere la secrezione del latte, Annali di Chimica Applicati alla Medicina, vol. 24 (3° s.), pp. 132-134.
-
COVELLO M., 1947, Ricerche chimiche e farmacologiche sulla Cannabis indica coltivata in Italia. I. Relazioni fra i caratteri chimico-analitici e l’attività farmacologica, Il Farmaco (Edizione Scientifica), vol. 2, pp. 503-517.
-
COVELLO M., 1948, Ricerche chimiche e farmacologiche sulla Cannabis indica coltivata in Italia. II. Degradazione dell’attività biologica della droga in rapporto all’invecchiamento e separazione cromatografica delle frazioni attive degli estratti alcoolico ed etereo, Il Farmaco (Edizione Scientifica), vol. 3, pp. 7-12.
-
CORRADI A. “Le prime farmacopee italiane, ed in particolare dei ricettari fiorentini” Memoria, ibid., CCLXXIX (1887), pp. 3-45, 179-216, 254-316, 321-388 e CCLXXXI (1887), pp. 81-125
-
CHOPRA, G. S. 1969. “Man and marijuana” The International Journal of the Addictions 4: 215–247 Clayton N, Marshall FH, Bountra C, O’Shaughnessy CT (2002) “CB1 and CB2 cannabinoid receptors are implicated in inflammatorypai” Pain 96: 253–260
-
CREMONA M., 2012, Giovanni Polli, 1812-1880. Un pioniere fra scienza, medicina, esperimenti cannabinici e cremazione di cadaveri, Pro Oggebbio, Oggebbio (Verbania), 48 pp
-
CROMBIE L. E CROMBIE W.M.L. (1975): Cannabinoid formation in Cannabis sativa L. grafted inter-racially, and with two Humulus species. Phytochemistry, 14: 409.
-
DAYANANDAN P. E KAUFMAN P.B. (1976): Trichomes of Cannabis sativa (Cannabaceae). American Journal of Botany, 63: 578-591.
-
DAYANANDAN, P., KAUFMAN, P.B., 1976. Trichomes of Cannabis sativa L. (Cannabaceae). Am. J. Bot. 63, 578–591
-
DAVIS WM, HATOUM NS (1983). “Neurobehavioral actions of cannabichromene and interactions with delta 9-tetrahydrocannabinol” Gen Pharmacol 14: 247–252
-
DAWSON R. WARREN, 1934, Studies in the Egyptian medical texts. III, Journal of Egyptian Archaeology, vol. 20, pp. 41-46.
-
De BEKER Innovative development and validation of an HPLC/DAD method for the qualitative and quantitative determination of major cannabinoids in cannabis plant material. 2009
-
DE MEJIER E.P.M., VAN DER KAMP H.J. E VAN EEUWIJK, F.A. (1992): Characterization of Cannabis accessions with regard to cannabinoid content in relation to other characters. Euphytica, 62: 187-200.
-
De MEIJER E.P.M. (1999): Cannabis germplasm resources. In “Advances in Hemp research”. The Haworth Press, Birghamton, NY, Pg. 133-151.
-
De MEIJER E.P.M., Bagatta M., Carboni A., Crucitti P., Moliterni V.M.C., Ranalli P. e Mandolino G. (2003): The inheritance of chemical phenotype in Cannabis sativa L. . Genetics Society of America, 163: 335-346.
-
DE MEIJER E. P. M., HAMMOND K. M., MICHELER M. “The inheritance of chemical phenotype in Cannabis sativa L. (III): variation in cannabichromene proportion” Euphytica January 2009, Volume 165, Issue 2, pp 293-311
-
DE MEIJER E. P. M., HAMMOND K. M., SUTTON A. “The inheritance of chemical phenotype in Cannabis sativa L. (IV): cannabinoid-free plants”, Euphytica (2009) 168:95–112 DOI 10.1007/s10681-009- 9894-7
-
DE OLIVEIRA AC, RIBEIRO-PINTO LF, PAUMGARTTEN JR (1997). “In vitro inhibition of CYP2B1 monooxygenase by beta-myrcene and other monoterpenoid compounds” Toxicol Lett 92: 39–46
-
DE PASQUALE A., TUMINO G. E DE PASQUALE R.C. (1974): Micromorphology of the epidermic surfaces of female plants of Cannabis sativa L. . UN Bulletin on Narcotics, 26: 27-40.
-
DE PETROCELLIS L, DI MARZO V (2010) “Non-CB1, non-CB2 receptors for endocannabinoids, plant cannabinoids, and synthetic cannabimimetics: focus on G-protein-coupled receptors and transient receptor potential channels” J Neuroimmune Pharmacol 5: 103–121
-
DE PETROCELLIS L, LIGRESTI A, MORIELLO AS, ALLARA M, BISOGNO T, PETROSINO S et al. (2011). “Effects of cannabinoids and cannabinoid-enriched Cannabis extracts on TRP channels and endocannabinoid metabolic enzymes” Br J Pharmacol DOI:10.1111/j.1476-5381.2010.0166.x
-
DE PETROCELLIS L, VELLANI V, SCHIANO-MORIELLO A, MARINI P, MAGHERINI PC, ORLANDO P et al. (2008). “Plant-derived cannabinoids modulate the activity of transient receptor potential channels of ankyrin type-1 and melastitin type-8” J Pharmacol Exp Ther 325: 1007–1015;
-
DE PETROCELLIS, L.; BISOGNO, T.; MACCARRONE, M.; DAVIS, J.B.; FINAZZI-AGRO, A.; DI MARZO, V. “The activity of anandamide at vanilloid VR1 receptors requires facilitated transport across the cell membrane”;
-
DE PETROCELLIS, L, D. DEL PRETE, D. CAPRIOGLIO, G. APPENDINO, A. MINASSI, A. SCHIANO-MORIELLO, V. DI MARZO, Discovery of non-electrophilic capsaicinoid-type TRPA1 ligands , Bioorganic & medicinal chemistry letters 01/2015 ;
-
DE ZEEUW R.A., MALINGRE TH.M. E MERKUS F.W.H.M. (1972): Tetrahydrocannabinol acid, an important component in the evaluation of Cannabis products. Journal of Pharm. and Pharmacognosy, 24: 1-6.
-
DEYO R, MUSTY R (2003). “A cannabichromene (CBC) extract alters behavioral despair on the mouse tail suspension test of depression” Proceedings 2003 Symposium on the Cannabinoids International Cannabinoid Research Society: Cornwall, ON, p. 146;
-
DI CANDILO M., RANALLI P., MARINO A. (1996): Influenza dell’investimento e della conimazione azotata sulla produzione di canapa da cellulosa (Cannabis sativa). Rivista di Agronomia, 30, 3: 258-263.
-
DI MARZIO, V., et al., “Leptin-regulated Endocannabinoids are Involved in Maintaining Food Intake”, in: Nature, vol. 410, 2001, pp. 822-825 ;
-
DI MARZO, V., FONTANA, A., CADAS, H., et al. (1994) “Formation and inactivation of endogenous cannabinoid anandamide in central neurons” Nature 372, 686–691 ,
-
DINIS, P.; CHARRUA, A.; AVELINO, A.; YAQOOB, M.; BEVAN, S.; NAGY, I.; CRUZ, F. “Anandamide-evoked activation of vanilloid receptor 1 contributes to the development of bladder hyperreflexia and nociceptive transmission to spinal dorsal horn neurons in cystitis” J. Neurosci., 2004, 24(50), 11253- 11263 ;
-
DIRIKOC S, PRIOLA SA, MARELLA M, ZSURGER N, CHABRY J (2007) “Nonpsychoactive cannabidiol prevents prion accumulation and protects neurons against prion toxicity” J Neurosci 27: 9537–9544 ;
-
DORVAULT F.L.M., 1849, Osservazioni farmacologiche sulla haschischina e sul suo uso nel cholera, Annali di Chimica Applicata alla Medicina, vol. 8, 3° s., pp. 379-384;
-
DORVAULT F.L.M., CARLO ERBA & GIOVANNI POLLI, 1849, Dell’haschisch e delle sue preparazioni, Annali di Chimica Applicati alla Medicina, 8 (3°s.) :83-97;
-
DOUTHWAITE AH (1947). “Choice of drugs in the treatment of duodenal ulcer” Br Med J 2: 43–47 ;
-
ECSEDY ISTVÁN, 1979, The people of the pit-grave kurgans in eastern Hungary, Akadémiai Kiadó, Budapest;
-
EHRENSING, D.T. 1998. Feasibility of industrial hemp production in the United States Pacific Northwest. Department of Crop and Soil Science, Oregon State Univ. Expt. Sta. Bul. 681. Oregon State University, Corvallis. www.css.orst.edu/Hemp/body.html
-
DRÈGE JEAN-PIERRE, 1987, Les débuts du papier en Chine, Comptes-Rendus des Séances de l’Académie des Inscriptions et Belles-Lettres, vol. 131, n. 4, pp. 642-652.
-
EL RICETTARIO DELL’ARTE ET UNIVERSITA DE MEDICI ET SPETIALI DELLA CITTA DI FIRENZE, riveduto dal Collegio de Medici per ordine dello illus. e eccell. Signor Duca di Firenze, stampato in Fiorenza appresso Lorenzo Torrentino stampator ducale, nel mese di settembre, l’anno 1550;
-
ELPHICK, M. R. AND EGERTOVA, M. (2001) “The neurobiology and evolution of cannabinoid signaling” Philos. Trans. R. Soc. Lond. B Biol. Sci. 356, 381–408 ;
-
EDERY H., MECHOULAM R., SHANI A. E GRUNFELD Y. (1970): Chemical basis of hashish activity. Science, 169: 611-612;
-
EISNER T. (1970): Chemical defense against predation in arthropods. Page 127 in “Chemical Ecology” edito da Sondheimer E. e Simone J.B., Academic Press, New York.
-
EL SOHLY H., TURNER C.E., CLARK A.M. E EL SOHLY M.A. (1982): Synthesis and antimicrobial properties of certain cannabichromene and cannabigerol related compounds. Journal of the Pharmaceutical Sciences, 71: 1319-1323.
-
ELSOHLY M.A., Slade D. “Chemical constituents of marijuana: The complex mixture of natural cannabinoids” 112 ;
-
ELSOHLY M.A. CHANDRA S., ROY U., KONG M. American Herbal Pharmacopeia Cannabis Inflorescence Standards of Identity, Analysis And Quality Control. Vol I 2013
-
EMERY-BARBIER ALINE, 1990, L’homme et l’environnement en Egypte durant la période prédynastique, in: S. Bottema, G. Entjes-Nieborg & W. Zeist (Eds.), Man’s Role in the Shaping of the East Mediterranean Landscape, A.A. Balkema, Rotterdam, pp. 319-326.
-
ENFSI.EU Education and training Outline for forensic drug practitioner. 2012
-
ERASMUS U. (1993): Fats that heal, fats that kill. Alive Books, 7436 Fraser Drive, Burnaby, BC, Canada VSJ5B9
-
ETHAN B. RUSSO “Taming THC: potential cannabis synergy and phytocannabinoid-terpenoid entourage effects”, British Journal of Pharmacology (2011) 163 1344–1364 Emboden W.A. (1972): Ritual use of Cannabis sativa L.: a historical-ethnographic survey. In “Flesh of the Gods”. P.T. Furst editore, New York, Pg. 214-236.
-
EMBODEN W.A. (1974): Cannabis, a polytypic genus. Economic Botany, 28: 304-310.
-
EMBODEN W.A (1977): A taxonomy for Cannabis. Taxon, 26:110.
-
ERBA CARLO, Comunicazioni ai signori medici, Milano, Opizzi Corno, 1907
-
EVANS A. T. (1991): Cannabinoids: the separation of central from peripheral effects on a structural basis. Planta Medica, 57: 60-67.
-
FAGGIANA G., “Standardizzazione e ottimizzazione del contenuto in cannabinoidi di due varietà di Cannabis sativa L., coltivate in un ambiente artificiale per applicazioni di tipo farmaceutico”. Tesi sperimentale di laurea, Università di Pavia 2013
-
FAIRBAIN J.W. (1972): The trichomes glands of Cannabis sativa L. UN Bulletin on Narcotics, 24: 29-33.
-
FAIRBAIRN J.W. E LIEBMANN J. (1974): The cannabinoid content of Cannabis sativa grown en England. Journal of Pharm. and Pharmacognosy, 26: 413-419.
-
FARMACOPEA FERRARESE del dottor Antonio Campana professore di chimica farmaceutica e botanica nella Università di Ferrara, Bologna Cardinali e Frulli 1828
-
FARKAS J. E ANDRASSY E. (1976): The sporostatic effect of cannabidiolic acid. Acta Alimentaria, 5: 57-67.
-
FELLERMEIER M. E ZENK M.H. (1998): Prenylation of olivetolate by a hemp transferase yelds cannabigerolic acid, the precursor of tetrahydrocannabinol. Federation of European Biochemical Societies (FEBS) letters, Monaco, Germania, 427: 283-285.
-
FETTERMAN P.S., KEITH E.S., WALLER C.W., GUERRERO O., DOORENBOS N.J. E QUIMBY M.W. (1971): Mississippi-grown Cannabis sativa L.: Preliminary observation on chemical definition of phenotype and variations in tetrahydrocannabinol content versus age, sex, and plant part. Journal of the Pharmaceutical Sciences, 60: 1246-1249.
-
FETTERMAN P.S., KEITH E.S., DOORENBONS N.J. E QUIMBY M.W. (1971): A simple gas liquid chromatography procedure for determination of cannabinoidic acids in Cannabis sativa L. . Experentia, 27: 988-990.
-
FORMUKONG, E.A., EVANS T. A. E EVANS F.J. (1988): Inhibition of the cataleptic effect of tetrahidrocannabinol by other constituents of Cannabis sativa L. Journal of Pharm. and Pharmacognosy, 40: 132-134.
-
FOURNIER G., PARIS M.R., FOURNIAT M.C. E QUERO A.M. (1978): Activitè bactèriostatique d’ huiles essentielles de Cannabis sativa L. . Annales Pharmaceutiques Francaises, 36: 603-606.
-
GALOCH E. (1978): The hormonal control of sex differentiation in dioecious plants of hemp. I: The influence of plant growth regulators on sex expression in male and female plants. Acta Soc. Bot. Pol., 47: 153-162.
-
GALOCH E. (1980) : The hormonal control of sex differentiation in dioecious plants of hemp. II: The effects of plants growth regulators upon development of excised stem tips cultured in vitro. Acta Physiol. Plantarum, 2: 3-7.
-
GALOCH E. (1980) : The hormonal control of sex differentiation in dioecious plants of hemp. III: The levels of phytoormones in male and female plants in the different stages of their development. Acta Physiol. Plantarum, 2: 31-39.
-
GAONI Y E MECHOULAM R. (1966): Hashish, VII. The isomerization of cannabidiol to tetrahidrocannabinols. Tetrahedron, 22: 1481-1488.
-
GAUTIER THÉOPHILE, 1979, Il club dei mangiatori di hascisc, Milano, Serra e Riva, 136 pp.
-
GRASSI G. E RANALLI P. (1999): Detecting and monitoring of plant THC content: Innovative and conventional methods, in “Advances in Hemp Research”. Haworth Press Inc., Binghamton, NY, Pg. 43-58.
-
GRASSI G. (1999): Rapid screening tests for the detection of delta-9-tetraidrocannabinolo (THC) in fibre hemp. Journal of the International Hemp Association, 6: 63-66.
-
GARETH P., BAKER D., “Potential Control of Multiple Sclerosis by Cannabis and the Endocannabinoid Gattefosse R-M (1993).
-
GERMER RENATE, 1985, Flora des pharaonischen Ägypten, Verlag Philipp von Zabern, Maina am Rhein.
-
GERSHENZON J (1994). “Metabolic costs of terpenoid accumulation in higher plants” J Chem Ecol 20:1281–1328
-
GERTSCH J (2008). “Anti-inflammatory cannabinoids in diet: towards a better understanding of CB(2) receptor action?” Commun Integr Biol 1: 26–28
-
GHELARDINI C, GALEOTTI N, SALVATORE G, MAZZANTI G (1999). “Local anaesthetic activity of the essential oil of Lavandula angustifolia” Planta Med 65: 700–703
-
GRINSPOON, L. E BAKALAR, J.B. (1997): “Marihuana, the Forbidden Medicine”. (revised and expanded edition), Yale University Press, New Haven (tradotta in italiano (2002): “Marihuana, la medicina proibita”. Editori Riuniti, Roma).
-
GILL EW, PATON WD, PERTWEE RG (1970). “Preliminary experiments on the chemistry and pharmacology of cannabis” Nature 228: 134–136
-
GIRARD M. & J. MALEY, 1987, Étude palynologique, Nouvelle Archives du Museum d’Histoire Naturelle de Lyon, vol. 25, pp. 103-110.
-
GLASS, M., DRAGUNOW, M., AND FAULL, R. L. M. (1997) “Cannabinoid receptors in the human brain: a detailed anatomical and quantitative autoradiographic study in the fetal, neonatal and adult human brain” Neuroscience 77, 299–318
-
GODARD, 1871, Preparazioni arabe dell’haschisch, Annali di Chimica Applicati alla Medicina, 52 (3°s.), pp. 142-146.
-
GRANT, S., A. HOUBEN, B. VYSKOT, J. SIROKY,W.H. PAN, J. MACAS & H. SAEDLER, (1994) “Genetics of sex determination in flowering plants” Dev Genet 15: 214–230
-
GRISHKO N.N., LEVCHENKO V.I. E SELETSKI V.I. (1937): Question of sex in hemp, the production of monoecious forms and of varieties with simultaneous ripening of both sexes. Vszesoy Nauchno-Issled Inst Konopli, Moscow 5: 73-108.
-
GRLIC L. e ANDREC A. (1961): The content of acid fraction in Cannabis resin of various age and provenience. Experentia, 17: 325-326.
-
GREGOR G., 1853, Dell’haschisch nei parti, Annali di Chimica Applicata alla Medicina, vol. 17 (3° s.), pp. 175-176.
-
GROTENHERMEN F. e RUSSO E. (2002): “Cannabis and Cannabinoids. Phamacology, Toxicology, and Therapeutic Potential”. The Haworth Press, Binghamton, NY, Pg. 431.
-
GRUNDZINSKAYA I.A. (1988): On the taxonomy of the cannabaceae. Journal of Botany, 73: 589-593.
-
HAKIM H.A., EL KHEIR Y.A. E MOHAMMED M.I. (1986): Effect of climate on the content of a CBD-rich variant of Cannabis. Fitoterapia, 57: 239-241.
-
HAMMOND C.T. E MAHLBERG P.G. (1973): Morphology of glandular hairs of Cannabis sativa from scanning electron microscopy. American Journal of Botany, 60: 524-528.
-
HAMPSON A. J., GRIMALDI M., AXELROD J. E WINK D. (1998): Cannabidiol and delta 9 tetrahidrocannabinol are neuroprotective antioxidans, Proc. Natl, Acad. Sci., USA, 95: 8268-8273.
-
HANAKER W.D. & M.D. MEADVILLE, 1892, Un caso di dose eccessiva di cannabis indica, Annali di Chimica Farmaceutica, vol. 15 (4° s.), pp. 252-254.
-
HANEY A. E BAZZAZ F.A. (1970): Discussion in: “The botany and chemistry of Cannabis”, Joyce, C.R.B. e Curry S.H., edito da Churchill, Londra.
-
HANEY A. E KUTSCHEID B.B. (1973): Quantitative variation in chemical constituents of marihuana from stands of naturalized Cannabis sativa L. in east central Illinois. Economic Botany, 27: 193-203.
-
HARRIS B (2010). “Phytotherapeutic uses of essential oils” In: Baser KHC, Buchbauer G (eds).
-
HANDBOOK OF ESSENTIAL OILS: SCIENCE, TECHNOLOGY, AND APPLICATIONS. CRC Press: Boca Raton, FL, pp. 315–352
-
HATOUM NS, DAVIS WM, ELSOHLY MA, TURNER CE (1981). “Cannabichromene and delta 9- tetrahydrocannabinol: interactions relative to lethality, hypothermia and hexobarbital hypnosis” Gen Pharmacol 12: 357–362
-
HAZEKAMP A. 2008-2009 Medicinal use of Cannabis a review. Dept. of plant metabolomics. Leiden Univ. NL
-
HAZEKAMP A., Cannabis, Extracting the medicine, Leiden Univ., 2007, 181p.
-
HEMPHILL JOHN K., TURNER J. C., MAHLBERG P.G., (1979) “Cannabinoid content of individual plant organs from different geographical strains of Cannabis sativa L”, Journal of Natural Products, Vol 43, no. 1.
-
HERER J. The emperor wears no clothes. 1985
-
HESLOP-HARRISON J. (1964): Sex expression in flowering plants. Brookhaven Symp. Biol., 16, 109-122.
-
HERKENHAM, M., LYNN, A. B., LITTLE, M. D., et al. (1990) “Cannabinoid receptor localization in brain” Proc. Natl. Acad. Sci. USA 87, 1932–1936
-
HESLOP-HARRISON J. (1964): Sex expression in flowering plants. Brookhaven Symp. Biol., 16, 109-122
-
HILL AJ, WESTON SE, JONES NA, SMITH I, BEVAN SA, WILLIAMSON EM et al. (2010). “Delta- Tetrahydrocannabivarin suppresses in vitro epileptiform and in vivo seizure activity in adult rats” Epilepsia 51: 1522–1532
-
HILLIG K.W. E MAHLBERG P.G. (2004) “A chemotaxonomic analysis of cannabinoid variation in Cannabis (Cannabaceae)” American Journal of Botany, 91: 966-975
-
HILLIG K.W. E MAHLBERG P.G. (2004): A chemotaxonomic analysis of cannabinoid variation in Cannabis (Cannabaceae). American Journal of Botany, 91: 966-975.
-
HIRATA K. (1928): Sex determination in hemp (Cannabis sativa L.). Journal of Genetics, 19: 65-79.
-
HOFFMANN W. (1952): Die Vererbung der Geschlechtsformen des Hanfes (Cannabis sativa L.). II Der Züchter, 22: 147-158.
-
HOLLAND ML, ALLEN JD, ARNOLD JC (2008). “Interaction of plant cannabinoids with the multidrug transporter ABCC1 (MRP1)” Eur J Pharmacol 591: 128–131
-
HOLLISTER L.E. E GILLESPIE B.A. (1975): Interactions in man of delta-9-tetrahidrocannabinol. II: Cannabinol and Cannabidiol. Clinical Pharmacology and Therapeutics, 18: 80-83.
-
HONMA S., KANESHIMA H., MORI M. E KITSUTAKA T. (1971-a). Cannabis grown in Hokkaido. 2. Contents of cannabinol, tetrahydrocannabinol and cannabidiol in wild Cannabis. Hokkaidoritsu Eisei Kenkyushoho, 21: 180-185.
-
HONMA S., KANESHIMA H., MORI M. E KITSUTAKA T. (1971-b). Cannabis grown in Hokkaido. 3. Variation in the amount of narcotic components of Cannabis and its growth. Hokkaidoritsu Eisei Kenkyushoho, 21: 186-190.
-
HOWLETT, A. C., BARTH, F., BONNER, T. I., et al. (2002) ”International union of pharmacology. XXVII. Classification of cannabinoid receptors” Pharmacol. Rev. 54, 161–202.
-
HUI-LIN LI., “The Origin and Use of Cannabis in Eastern Asia Linguistic-Cultural Implications”.
-
Ibrahim MM, Deng HF, Zvonok A, Cockayne DA, Kwan J, Mata HP et al. (2003)
-
ICH International Conference on Harmonization. 2011 guidelines.
-
IZZO A.A., BORRELLI F., CAPASSO R., DI MARZO V., MECHOULAM R. 2009 Non psycotropic plant cannabinoids, new therapeutic opportunities from an ancient herb” Trends Pharmacol. Sci. 30:515-27
-
JANISCHEWSKY D.E. (1924): Forma konopli na sorhykh mestakh v. Yugovostochnoi Rossii. Uchenye zapiski saratovsskogo gosudar-stvennogo universitate imeni N.G. Chernyshevskogo Saratov, 2: 3-17.
-
JETTMAR KARL, 1964-65, The Slab with a Ram’s Head in the Rietberg Museum, Artibus Asiae, vol. 27, pp. 291-300.
-
JETTMAR KARL, 1981, Skythen und Haschisch, in: G. Völger (Hg.), Rausch und Realität, Köln, Rautenstrauch-Joest Museum für Völkerkunde, vol. 2, pp. 530-536.
-
JIANG HONG-EN et al., 2006, A new insight into Cannabis sativa (Cannabaceae) utilization from 2500-year-old Yanghai Tombs, Xinjiang, China, Journal of Ethnopharmacology, vol. 108, pp. 414-422.
-
JIANG HONG-EN et al., 2007, The discovery of Capparis spinosa L. (Capparidaceae) in the Yanghai Tombs (2800 years B.P.), NW China, and its medicinal implications, Journal of Ethnopharmacology, vol. 113, pp. 409-420.
-
JIROVETZ L, BUCHBAUER G, JAGER W, WOIDICH A, NIKIFOROV A (1992). “Analysis of fragrance compounds in blood samples of mice by gas chromatography, mass spectrometry, GC/FTIR and GC/AES after inhalation of sandalwood oil” Biomed Chromatogr 6: 133–134
-
JONES G. E PERTWEE R.G. (1972): A metabolical interaction in vivo between cannabidiol and delta9-tetrahydocannabinol. British Journal of Pharmacology, 45 : 375-377.
-
JONES K. (1995): Nutritional and medicinal guide to hemp seed. Rainforest Botanical Laboratory, P.O. Box 1793, Gibsons, BC, Canada VON1VO.
-
JOHNS DG, BEHM DJ, WALKER D, AO Z, PARSONS M, DANIELS D et al. (2007) “The novel endocannabinoid receptor GPR55 binds atypical cannabinoids but does not mediate their vasodilatory effects” Br J Pharmacol;
-
JOHNSON JR, BURNELL-NUGENT M, LOSSIGNOL D, GANAE-MOTAN ED, POTTS R, FALLON MT (2010). “Multicenter, double-blind, randomized, placebo-controlled, parallel-group study of the efficacy, safety, and tolerability of THC:CBD extract and THC extract in patients with intractable cancer- related pain” J Pain Symptom Manage 39: 167–179
-
KABELIK J., KREJCI Z. E SANTAVY F. (1960): Cannabis as a medicament. UN Bulletin on Narcotics, 12: 5-23.
-
KANESHIMA H., MORI M. E MIZUNO N. (1973): Studies on Cannabis in Hokkaido (part 6). The dependance of Cannabis plants on Iron nutrition. Hokkaidoritsu Eisei Kenkyussho, 23: 3-5.
-
KARSAK M, GAFFAL E, DATE R, WANG-ECKHARDT L, REHNELT J, PETROSINO S et al. (2007). “Attenuation of allergic contact dermatitis through the endocannabinoid system” Science 316: 1494–1497
-
KIM, E.S., MAHLBERG, P.G., 1991. Secretory cavity development in glandular trichomes of Cannabis sativa L. (Cannabaceae). Am. J. Bot. 78, 220–229 116
-
KIM, E.S., MAHLBERG, P.G., 1997. Immunochemical localization of tetrahydrocannabinol (THC) in cryofixed glandular trichomes of Cannabis (Cannabaceae). Am. J. Bot. 84, 336–342
-
KIM, E.S., MAHLBERG, P.G., 2003. Secretory vesicle formation in the secretory cavity of glandular trichomes of Cannabis sativa L. (Cannabaceae). Mol. Cells 15, 387–395
-
KIMURA M. E OKAMOTO K. (1970): Distribution of tetrahydrocannabinolic acid in fresh wild Cannabis. Experentia, 26: 819-820.
-
KNAUER ELFRIEDE REGINA, 1999, Le vêtement des nomades eurasiatiques et sa postérité, Comptes-Rendus des Séances des l’Académie des Inscriptions et Belle-Lettres, vol. 143(4), pp. 1141-1187.
-
KO CHIN, 1972, Account of excavation of an Early Chou tomb at Kao-chia-pao, Chin-yang, Wen-wu, vol. 7, pp. 5-7.
-
KÖHLER D. (1961): Ein Beitrag zur Physiologie und Genetik der Geschlechtsausprägung von Cannabis sativa L. . Planta, 56: 150-173.
-
KOHNO, M.; HASEGAWA, H.; INOUE, A.; MURAOKA, M.; MIYAZAKI, T.; OKA, K.; YASUKAWA, M. “Identification of N-arachidonylglycine as the endogenous ligand for orphan G-protein-coupled receptor GPR18” Biochem. Biophys. Res. Commun., 2006, 347(3), 827-832
-
KOMIYA M, TAKEUCHI T, HARADA E (2006). “Lemon oil vapor causes an anti-stress effect via
-
modulating the 5-HT and DA activities in mice” Behav Brain Res 172: 240–249
-
KOSE EO, DENIZ IG, SARIKURKCU C, AKTAS O, YAVUZ M (2010). “Chemical composition, antimicrobial and antioxidant activities of the essential oils of Sideritis erythrantha Boiss. and Heldr. (var. erythrantha and var. cedretorum P.H. Davis) endemic in Turkey” Food Chem Toxicol 48: 2960–2965
-
KUDO Y. et al., 2009, Radiocarbon dating of the fossil hemp fruits in the eraliest Jomon period from the Okinoshima Site, Chiba, Japan, Japanese Journal of Historical Botany, vol. 17, pp. 27-32 (in giapp. Con riassunto in inglese)
-
LANGENHEIM JH (1994). “Higher plant terpenoids: a phytocentric overview of their ecological roles” J Chem Ecol 20: 1223–1279
-
KREJCI Z. (1970): Changes with maturation in amounts of biologically interesting substances of Cannabis. Pagina 49 in “The botany and chemistry of Cannabis”. Joyce, C.R.B. e Curry S.H, edito da Churchill, Londra.
-
LAMARCK J.B. (1785): Encyclopédique Méthodique Botanique. 1: 694-695.
-
LANYON V.S., TURNER J.C. E MAHLBERG P.G. (1981): Quantitative analysis of cannabinoids in the secretory product from capitate-stalked glands of Cannabis sativa L. (Cannabaceae). Botanical Gazette, 142: 316-319.
-
LATTA R.P. E EATON B.J. (1975): Seasonal fluctations in cannabinoid content of Kansas marijuana. Economic Botany, 29: 153-163.
-
LEDBETTER M.C. E KRIKORIAN A.D. (1975). Trichomes of Cannabis sativa as viewed with scanning electron microscope. Phytomorphology, 25: 166-176.
-
LERCKER G., BOCCI F., FREGA N. E BORTOLOMEAZZI R. (1992): Cannabinoid acid analysis. Il Farmaco, 47: 367-378.
-
LEROI-GOURHAN ARLETTE, 1985, Les pollens et l’embaumement, in: L. Balout, C. Roubet & C. Desroches Noblecourt (Eds.), La Momie de Ramsès II: contribution scientifique à l’égyptologie, Editions Recherche sur les Civilisations, Paris, pp. 162-165.
-
LEVIN D.A. (1973): The role of trichomes in plant defense. Quarterly Rewiew of Biology, 48: 3-16.
-
LI HUI-LIN, 1974a, An Archaeological and Historical Account of Cannabis in China, Economic Botany, vol. 28, pp. 437-448.
-
LI HUI-LIN, 1974b, The Origin and the Use of Cannabis in Eastern Asia. Linguistic-Cultural Implications, Economic Botany, vol. 28, pp. 293-301.
-
LIGRESTI A, MORIELLO AS, STAROWICZ K, MATIAS I, PISANTI S, DE PETROCELLIS L. et al. (2006). ”Antitumor activity of plant cannabinoids with emphasis on the effect of cannabidiol on human breast carcinoma” J Pharmacol Exp Ther 318: 1375–1387
-
LONGO B., 1931, Bullettino Orto Botanico di Napoli, 11:8; Longo Biagio, 1937, Bullettino Orto Botanico di Napoli, 14:43; Longo Biagio, 1937, Rivista Fisica Matematica Scienze Naturali, 11:7. -
-
LOPES NP, KATO MJ, ANDRADE EH, MAIA JG, YOSHIDA M, PLANCHART AR et al. (1999). “Antimalarial use of volatile oil from leaves of Virola surinamensis (Rol.)” Warb. by Waiapi Amazon Indians. J Ethnopharmacol 67: 313–319
-
LORENZETTI BB, SOUZA GE, SARTI SJ, SANTOS FILHO D, FERREIRA SH (1991). “Myrcene mimics the peripheral analgesic activity of lemongrass tea” J Ethnopharmacol 34: 43–48
-
MACKIE K, STELLA N (2007). Cannabinoid receptors and endocannabinoids: evidence for new players. AAPS J 8: E298–E306
-
LYDON J. E TERAMURA A.H. (1987): Photochemical decomposition of cannnabidiol in its resin base. Phytochemistry, 26: 1216-1217.
-
LYDON J., TERAMURA A.H. E COFFMAN J.B. (1987): UV-B radiation effects on photosynthesis, growth and cannabinoid production of two Cannabis sativa chemotypes. Photochemistry and Photobiology, 46: 201-206.
-
LUSSANA F., 1851, Alcuni effetti dell’Hachisch, Gazzetta Medica di Milano, vol. 2 (3° s.) pp. 441-442.
-
MAGEN I, AVRAHAM Y, ACKERMAN Z, VOROBIEV L, MECHOULAM R, BERRY EM (2009). “Cannabidiol ameliorates cognitive and motor impairments in mice with bile duct ligation” J Hepatol 51: 528–534
-
MAHLBERG P.G. E KIM E.S. (2003): THC (Tetrahydrocannabinol) accumulation in glands of Cannabis (Cannabaceae). Journal of the Industrial Hemp, 9: 15-36.
-
MALFAIT AM, GALLILY R, SUMARIWALLA PF, MALIK AS, ANDREAKOS E, MECHOULAM R et al. (2000). “The nonpsychoactive cannabis constituent cannabidiol is an oral anti-arthritic therapeutic in murine collagen-induced arthritis” Proc Natl Acad Sci USA 97: 9561–9566.
-
MALINGRÈ T., HENDRICKS H., BATTERMANN S., BOS R. E VISSER J. (1975): The essential oil of Cannabis sativa. Planta Medica, 28: 56-61.
-
MALINGRÈ T., HENDRICKS H., BATTERMANN S. E BOS R. (1975): Mono- and Sesqui-terpenes hydrocarbons of the essential oil of Cannabis sativa. Phytochemistry, 14: 814-815.
-
MAOR Y, GALLILY R, MECHOULAM R (2006). “The relevance of the steric factor in the biological activity of CBD derivaties-a tool in identifying novel molecular target for cannabinoids” In: Symposium on the Cannabinoids. International Cannabinoid Research Society: Tihany, Hungary.
-
MARKS, M.D., TIAN, L., WENGER, J.P., OMBURO, S.N., SOTO-FUENTES, W., HE, J., GANG, D.R., WEIBLEN, G.D., DIXON, R.A., 2009. Identification of candidate genes affectingDelta(9)-tetrahydrocannabinol biosynthesis in Cannabis sativa. J. Exp. Bot. 60,3715–3726.
-
MANDOLINO G., CARBONI A., FORAPANI S., FAETI V. E RANALLI P. (1999): Identification of DNA markers linked to the male sex in dioecious hemp (Cannabis sativa L.). Teor. Appl. Genet., 98: 86-92.
-
MANLIIS de BOSCO J.J., “Luminare Maius sive interpretatio super descriptions antidodari. Mesue. Impressum in inclyta civitate Papia studiorum omnium altrice per M. Antonium de Carcano mediolanensem impres. degnissimum 1494 die 9 aprilis”.
-
MANNICHE LISE, 1989, An Ancient Egyptian Herbal, University of Texas Press, Austin.
-
MANSINGH A. E WILLIAMS L.A.D. (1998): Pesticidal potential of tropical plants-II. Acaricidal activity of crude extracts of several Jamaican plants. Insect Sciences Applied, 18: 149-155.
-
MARSHMAN J., YAWNEY C.D. E POPHAM R.E. (1976): A note on the cannabinoid content of Jamaican ganja. UN Bulletin on Narcotics, 28: 63-68.
-
MARTIN G.T., 1989, Tomb of Amenophis IV, Egypt Exploration Society, London, 2 voll.
-
MARTIN L., Smith D.M. e Farmilo C.G. (1961): Essential oil from fresh Cannabis sativa L. and its use in identification. Nature, 191: 774-776.
-
MASOUD A.N. E DOOREBONS N.J. (1973): Mississipi grown Cannabis sativa L. III. Cannabinoid and cannabinoic acid contents. Journal of the Pharmaceutical Sciences, 62: 313-315.
-
MATSUI AKIRA & MASAAKI KANEHARA, 2006, The question of prehistoric plant husbandry during the Jomon Period in Japan, World Archaeology, vol. 38, pp. 259-273.
-
MATHÈ P. E BÒCSA I. (1995): Can THC occur in hemp seed oil ? Journal of the International Hemp Association, 2: 59.
-
MATSUDA L.A., LOLAIT S.J., BROWNSTEIN M.J., YOUNG A.C. E BONNER TI (1990): Structure of a cannabinoid receptor and functional expression of the cloned cDNA. Nature, 346: 561-564.
-
MCGINTY D, LETIZIA CS, API AM (2010). “Fragrance material review on phytol” Food Chem Toxicol 48 (Suppl. 3): S59–S63.
-
MCHUGH D, HU SS, RIMMERMAN N, JUKNAT A, VOGEL Z, WALKER JM et al. (2010) “N-arachidonoyl glycine, an abundant endogenous lipid, potently drives directed cellular migration through GPR18, the putative abnormal cannabidiol receptor” BMC Neurosci 11: 44
-
MCPARTLAND J.M. (1984): Pathogenicity of Phomopsis ganjae on Cannabis sativa and the fungistatic effect of cannabinoids produced by the host. Mycopathologia, 87: 149-154.
-
MCPARTLAND J.M. (1996): A review of Cannabis Diseases. Journal of the International Hemp Association, 3: 19-23.
-
MCPARTLAND J.M. (1996): Cannabis Pest. . Journal of the International Hemp Association, 3: 52-55.
-
MCPARTLAND J.M. e Pruitt P.P. (1999): Side effects of pharmaceuticals not elicited by comparable herbal medicines: the case of tetrahidrocannabinol and marijuana. Alternative Therapies, 3: 39-45.
-
MCPARTLAND J.M., Clarke R.C., Watson D.P.; Hemp diseases an pest management and biological control. 2002
-
MCPHEE H. (1925): The influence of environment on sex in hemp. Journal of Agronomic research, 31: 935-943.
-
MECHOULAM R. E GAONI Y. (1965): Hashish IV. A total synthesis of the delta-1-THC, the active constitutent of hashish. Journal of the American Chemical Society, 87: 3273-3274.
-
MECHOULAM R. E GAONI Y. (1965): Hashish IV. The isolation of cannabinolic, cannabidiolic and cannabigerolic acids. Tetrahedron, 21: 1223-1229.
-
MECHOULAM R. E GAONI Y. (1971): The isolation and structure of delta-1-tetrahydrocannabinol and other neutral cannabinoids from hashish. Journal of the American Chemical Society, 93: 217-224.
-
MECHOULAM R., DEVANE W.A., HANUS L., BREUER A., PERTWEE R.G., STEVENSON L.A., GRIFFIN G., GIBSON D., MANDELBAUM A. E ETINGER A. (1992): Isolation and structure of a brain costituent that binds to the cannabinoid receptor. Science, 258: 1946-1949.
-
MECHOULAM R., HANUS L., GOPHER A. E ALMOG S. (1993): Two new unsaturated fatty acid ethanolamides in brain that bind to the cannabinoid receptor. Journal of Med. Chem., 36: 3032-3034.
-
MECHOULAM R., BAYEWITCH M., AVIDOR-REISS T., LEVY R., BARG J. E VOGEL Z. (1995): The peripheral cannabinoid receptor: adenylate cyclase inhibition and G protein coupling. FEBS Letters, 375: 143-147.
-
MECHOULAM R., BEN-SHABAT S., HANUS L., LIGUMSKY M., KAMINSKI N.E., SCHATZ A.R., GOPHER A., ALMOG S., MARTIN B.R., COMPTON D.R., PERTWEE R.G., GRIFFIN G., BAYEWITCH M., BARG J. E VOGEL Z. (1995): Identification of an endogenous 2-monoglyceride, present in canine gut, that binds to cannabinoid receptors. Biochem. Pharmacology, 50: 83-90.
-
MECHOULAM R., ZUARDI A.W., MORAIS S.L. E GUIMARAES F.S. (1995): Antipsychotic effect of cannabidiol. Journal of Clinical Psychiatry, 56: 485-486.
-
MECHOULAM R. E BEN-SHABAT S. (1999): From gan-zi-gun-nu to anandamide and 2-arachidonoylglycerol: the ongoing story of cannabis. Natural Product Review, 16: 131-143.
-
MECHOULAM R, PETERS M, MURILLO-RODRIGUEZ E, HANus LO (2007) “Cannabidiol – recent advances” Chem Biodivers 4: 1678–1692
-
MEDIAVILLA V. E STEINEMANN S. (1997): Essential oil of Cannabis sativa L. strains. Journal of the International Hemp Association, 4: 82-84.
-
MEHMEDIC Z, CHANDRA S, SLADE D, DENHAM H, FOSTER S, PATEL AS ET Al. (2010) “Potency trends of delta(9)-THC and other cannabinoids in confiscated cannabis preparations from 1993 to 2008” J Forensic Sci 55: 1209–1217
-
MERZOUKI A, MESA JM (2002). “Concerning kif, a Cannabis sativa L. preparation smoked in the Rif mountains of northern Morocco” J Ethnopharmacol 81: 403–406
-
MESCHLER J.P. E HOWLETT A.C. (1999): Thujone exibit low affinity for cannabinoid receptors but fails to evoke cannabimimetic responses. Pharm. Biochem. Behav., 62: 473-480.
-
MEUNIER RAYMOND, 1909, Le Hachich. Essai sur la psychologie des Paradis éphémères, Librairie Bloud & C., Paris.
-
MIKURIYA T.H. (1969): Marihuana in medicine: past, present and future. California medicine, 110: 34-40.
-
MOHAN RAM H.Y. (1980): Hormones and flower sex. Plant Biochemistry Journal, 8: 77-88.
-
MOHAN RAM H.Y. e Sett R. (1982): Induction of fertile male flowers in genetically female Cannabis sativa plants by silver nitrate and silver thiosulphate anionic complex. Theor. Appl. Genetics, 62: 369-375.
-
MOLITERNI C., CATTIVELLI L., RANALLI P., MANDOLINO G., “The sexual differentiation of Cannabis sativa L.: A morphological and molecular study” Euphytica 140: 95–106, 2004. 2004 Kluwer Academic Publishers
-
MORGUNOVA N.L. & O.S. KHOKHLOVA, 2006, Kurgans and nomads: new investigations of mound burials in the southern Urals, Antiquity, vol. 80, pp. 303-317.
-
MORIMOTO S, TANAKA Y, SASAKI K, TANAKA H, FUKAMIZU T, SHOYAMA Y et al. (2007) “Identification and characterization of cannabinoids that induce cell death through mitochondrial permeability transition in Cannabis leaf cells” J Biol Chem 282: 20739–20751
-
MUKERJI G, YIANGOU Y, CORCORAN SL, SELMER IS, SMITH GD, BENHAM CD et al. (2006). Cool and menthol receptor TRPM8 in human urinary bladder disorders and clinical correlations” BMC Urol 6:
-
MULLER C.H., MULLER W.H. E HAINES B.L. (1964): Volatile growth inhibitors produced by aromatic shrubs. Science, 143: 471-473.
-
MUNRO S., THOMAS K.L. E ABU-SHAAR M. (1993): Molecular characterization of a peripheral receptor for cannabinoids. Nature, 365: 61-65.
-
MURARI G., LOMBARDI S., PUCCINI A.M. E DE SANCTIS R. (1983): Influences of enviromental conditions on tetrahydrocannabinol (delta-9-THC) in different cultivars of Cannabis sativa L. . Fitoterapia, 54: 195-201.
-
MUSTY R, DEYO R (2006). “A cannabigerol extract alters behavioral despair in an animal model of depression” Proceedings June 26; Symposium on the Cannabinoids. International Cannabinoid Research Society: Tihany, p. 32
-
MUSTY RE, KARNIOL IG, SHIRIKAWA I, TAKAHASHI RN, KNOBEL E (1976). “Interactions of delta-9- tetrahydrocannabinol and cannabinol in man.” In: Braude MC, Szara S (eds). The Pharmacology of Marihuana, Vol. 2. Raven Press: New York, pp. 559–563
-
NEFF GW, O’BRIEN CB, REDDY KR, BERGASA NV, REGEV A, MOLINA E et al. (2002). “Preliminary observation with dronabinol in patients with intractable pruritus secondary to cholestatic liver disease” Am J Gastroenterol 97: 2117–2119
-
NEMETH, J.; HELYES, Z.; THAN, M.; JAKAB, B.; PINTER, E.; SZOLCSANYI, J. “Concentration-dependent dual effect of anandamide on sensory neuropeptide release from isolated rat tracheae” Neurosci. Lett., 2003, 336(2), 89-92
-
NERIO L.S, OLIVERO-VERBEL J, STASHENKO E (2010). “Repellent activity of essential oils: a review” Bioresour Technol 101: 372–378
-
NICHOLSON AN, TURNER C, STONE BM, ROBSON PJ (2004). “Effect of delta-9-tetrahydrocannabinol and cannabidiol on nocturnal sleep and early-morning behavior in young adults” J Clin Psychopharmacol 24: 305–313
-
NISSEN L, ZATTA A, STEFANINI I, GRANDI S, SGORBATI B, BIAVATI B ET AL. (2010). “Characterization and antimicrobial activity of essential oils of industrial hemp varieties (Cannabis sativa L.)” Fitoterapia 81: 413–419
-
NOMA Y, ASAKAWA Y (2010). “Biotransformation of monoterpenoids by microorganisms, insects, and mammals” In: Baser KH, Buchbauer G (eds). Handbook of Essential Oils: Science, Technology, and Applications. CRC Press: Boca Raton, FL, pp. 585–736
-
NOMA Y, ASAKAWA Y (2010). Biotransformation of monoterpenoids by microorganisms, insects, and mammals. In: Baser KHC, Buchbauer G (eds). Handbook of Essential Oils: Science, Technology, and Applications. CRC Press: Boca Raton, FL, pp. 585–736
-
NUOVO RECEPTARIO COMPOSTO DAL FAMOSISSIMO CHOLLEGIO DEGLI EXIMI DOCTORI DELLA ARTE ED MEDICINA DELLA INCLITA CIPTA DI FIRENZE, impresso per la Compagnia del Dragho adi XXI di gen* 1498.
-
NUNN F. JOHN, 1996, Ancient Egyptian Medicine, The British Museum Press, London.
-
OHLSSON A., ABOU-CHAAR C.I., AGURELL S., NILSSON I.M., OLOFSSON K. E SANDBERG F. (1971): Cannabinoid constituents of male and female Cannabis sativa. UN Bulletin on Narcotics, 23: 29-32.
-
OKAZAKI HIROKO et al. 2011, Early Holocene coastal environment change inferres from deposits at Okinoshima archeological site, Boso Peninsula, central Japan, Quaternary International, vol. 230, pp. 87-94.
-
O’NEIL J.D., DALTON W.S. E FORNEY R.B. (1979): The effect of cannabichromene on mean blood pressare, heart rate, and respiration rate responses to tetrahidrocannabinol in the anesthetized rat. Toxicology Applied Pharmacology, 49: 265-270.
-
O'SHAUGHNESSY, R., 1839. Case of Tetanus, Cured by a Preparation of Hemp (the Cannabis indica.), Transactions of the Medical and Physical Society of Bengal 8, 1838-40, 462-469.
-
O'SHAUGHNESSY, W.B. 1831. Proposal of new method of treating blue epidemic cholera by injection of highly-oxygenized salts into venous system. Lancet 1, 1831-32, 366-371.
-
O'SHAUGHNESSY, W.B. 1832. Report on the Chemical Pathology of the Malignant Cholera, etc. London: S. Highley, (1832).
-
O'SHAUGHNESSY, W.B., (1838). Memoranda on Indian Materia Medica, presented to the Royal Society October 6, (1838).
-
O'SHAUGHNESSY, W.B., (1839). On the Preparations of the Indian Hemp, or Gunjah, Transactions of the Medical and Physical Society of Bengal, 8, 1838-40, 421-461. Reprinted in Mikuriya, 1973, 3-30.
-
O'SHAUGHNESSY, W.B. (1839) Case of Tetanus, Cured by a Preparation of Hemp (the Cannabis indica.), Transactions of the Medical and Physical Society of Bengal 8, 1838-40, 462-469
-
PARIS M., BOUCHER F. e COSSON L. (1975) : The constituents of Cannabis sativa pollen. Economic Botany, 29: 245- 253.
-
PAGANI S., 1995, L’addomesticamento della molecola selvaggia. Tabacco e cannabis a confronto, Altrove, vol. 2, pp. 67-75.
-
PAN CHI-HSIN, 1964, The earliest plant-fiber paper in the world, Wen-wu, vol. 11, pp. 48-49. [in cinese]
-
PAROLARO D., MASSI P., VACCANI A., CERUTI S., COLOMBO A. E ABBRACCHIO M.P. (2003): Antitumor effects of cannabidiol, a non-psychotropic cannabinoid, on human glioma cell lines. Journal of Pharmacology And Experimental Therapeutics Fast Forward, 308: 838-45.
-
PASHKEVICH G., 1999, New evidence for plant exploitation by the Scythian tribes during the early Iron Age in the Ukraine, Acta Palaeobotanica, suppl. 2, pp. 597-601.
-
PATE D.W. (1983): Possibile role of ultraviolet radiation in evolution of Cannabis chemotypes. Economic Botany, 37: 396-405.
-
PATE, D.W. (1994): Chemical ecology of Cannabis. Journal of the International Hemp Association, 2: 29-37.
-
PARKER LA, MECHOULAM R, SCHLIEVERT C (2002). “Cannabidiol, a non-psychoactive component of cannabis and its synthetic dimethylheptyl homolog suppress nausea in an experimental model with rats” Neuroreport 13: 567–570
-
PAROLARO D, MASSI P (2008). “Cannabinoids as potential new therapy for the treatment of gliomas” Expert Rev Neurother 8: 37–49
-
PAULI A, SCHILCHER H (2010). In vitro antimicrobial activities of essential oils monographed in the European Pharmacopoeia 6th Edition. In: Baser KHC, Buchbauer G (eds). Handbook of Essential Oils: Science, Technology, and Applications. CRC Press: Boca Raton, FL, pp. 353–548
-
PERRY NS, HOUGHTON PJ, THEOBALD A, JENNER P, PERRY EK (2000). “In-vitro inhibition of human erythrocyte acetylcholinesterase by salvia lavandulaefolia essential oil and constituent terpenes” J Pharm Pharmacol 52: 895–902
-
PERTWEE RG (2004). The pharmacology and therapeutic potential of cannabidiol. In: DiMarzo V (ed.). Cannabinoids. Kluwer Academic Publishers: Dordrecht, pp. 32–83
-
PERTWEE RG (2007). “Cannabigerol behaves as a partial agonist at both CB1 and CB2 receptors” Proceedings 17th Annual Symposium on the Cannabinoids. International Cannabinoid Research Society: Saint-Sauveur, QC, p. 206
-
PERTWEE RG (2008). “The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: delta9-tetrahydrocannabinol, cannabidiol and delta9-tetrahydrocannabivarin” Br J Pharmacol 153: 199–215
-
PERTWEE, R. G. AND ROSS, R. A. (2002) “Cannabinoid receptors and their ligands” Prostaglandins Leukot. Essent. Fatty Acids 66(2, 3), 101–121
-
PETITET F., JEANTAUD B., REIBAUD M., IMPERATO A. E DUBROEUCQ M.C. (1998) : Complex Pharmacology of natural cannabinoids : evidence for partial agonist activity of delta-9-tetrahidrocannabinol and antagonist activity of cannabidiol on rat brain cannabinoid receptors. Life Sciences, 63: 1-6.
-
PETROSINO S. ET AL. (2011) “Effects of cannabinoids and cannabinoid-enriched Cannabis extracts on TRP channels and endocannabinoid metabolic enzymes” Br J Pharmacol DOI:10.1111
-
POLLACCI G. & M. GALLOTTI, 1940, Canapa indiana coltivata in Lombardia, Bollettino della Società Italiana di Biologia Sperimentale, vol. 15, pp. 325-325.
-
POLLI G., 1854, Raccomandazione di un rimedio nel cholera, Annali di Chimica Applicati alla Medicina, 19 (3°s.) :173-177.
-
POLLI G., 1860, Esperimenti sugli effetti dell’haschish ad alta dose, Annali di Chimica Applicati alla Medicina, vol. 30 (3° sw.), pp. 23-34 e 89-103.
-
POLLI G., 1860, Risultato di un esperimento terapeutico dell’haschisch nell’idrofobia, Annali di Chimica Applicati alla Medicina, vol. 31 (3° s.), pp. 366-371.
-
POLLI G., 1863, Lipemania guarita coll’haschisch, Annali di Chimica Applicati alla Medicina, vol. 36 (3°s.), pp. 72-75.
-
POLLI G., 1865, Sull’antidoto dell’haschisch, Annali di Chimica Applicata alla Medicina, vol. 40, 3° s., pp. 343-345.
-
POTTER DAVID J.P., (2013) “A review of the cultivation and processing of Cannabis (Cannabis sativa L.) for production of prescription medicines in the UK”
-
POTTER DAVID J.P., (2009) (PhD) in Pharmaceutical Sciences “The Propagation, Characterisation and Optimasation of Cannabis Sativa L as a Phytopharmaceutical”
-
POPESCU GRIGORE ARBORE, ANDREI ALEKSEEV & JURIJ PIOTROVSKIJ (cur.), 2001, Siberia. Gli uomini dei fiumi ghiacciati, Electa, Milano.
-
PULTRINI ADE M, GALINDO LA, COSTA M (2006). “Effects of the essential oil from Citrus aurantium L. in experimental anxiety models in mice” Life Sci 78: 1720–172
-
QIN N, NEEPER MP, LIU Y, HUTCHINSON TL, LUBIN ML, FLORES CM (2008). “TRPV2 is activated by cannabidiol and mediates CGRPrelease in cultured rat dorsal root ganglion neurons” J Neurosci 28: 6231–6238
-
QUIMBY M.W. (1974): Botany of Cannabis sativa. Arch. Invest. Med. 5 Suppl., 1: 127.
-
QUIRICUS de AUGUSTIS, “Lumen Apothecariorum”, Cremonae, C.p.d. Malibeus Gallicum 1494.
-
RANALLI P. e CASARINI B. (1998): “Canapa: il ritorno di una coltura prestigiosa. Nuove produzioni di fibra e cellulosa”. Avenue Media, Bologna, Pg. 271.
-
RANALLI P. (1999): “Advances in Hemp Research”. The Haworth Press, Binghamton, NY, Pg. 272.
-
ROBINSON VICTOR, 1925, An Essay on Hasheesh. Historical and Experimental, E.H. Ringer Publisher, New York, 92 pp.
-
ROTHSHILD M., ROWEN M.G. E FAIRBAIRN G.W. (1977): Storage of cannabinoids by Arctia caja and Zonocerus elegans fed on chemically distinct strains of Cannabis sativa. Nature, 266: 650-651.
-
ROTHSHILD M. E FAIRBAIRN G.W. (1980): Ovipositing butterfly (Pieris brassicae L.) distinguishes between aqueous extracts of two strains of Cannabis sativa L. and THC e CBD. Nature, 286: 56-59.
-
RANDALL, R., Marihuana, Medicine and the Law, Vol.2, Galen Press, Washington DC, 1989, pp. 36- 63
-
RE L, BAROCCI S, SONNINO S, MENCARELLI A, VIVANI C, PAOLUCCI G Et al. (2000). “Linalool modifies the nicotinic receptor-ion channel kinetics at the mouse neuromuscular junction” Pharmacol Res 42: 177–182
-
RHEE MH, VOGEL Z, BARG J, BAYEWITCH M, LEVY R, HANUS L et al. (1997). “Cannabinol derivatives: binding to cannabinoid receptors and inhibition of adenylylcyclase” J Med Chem 40: 3228–3233
-
RICETTARIO SANESE di G. Domenico Olmi, Siena per L. e B. Bindi 1777.
-
RIEDEL G, FADDA P, MCKILLOP-SMITH S, PERTWEE RG, PLATT B, ROBINSON L (2009). “Synthetic and plant- derived cannabinoid receptor antagonists show hypophagic properties in fasted and non-fasted mice” Br J Pharmacol 156: 1154–1166
-
ROBSON, P., “Cannabis as Medicine: Time for the Phoenix to Rise?”, in: Br Med J, vol. 316, 1998, p.1034
-
ROBSON, P., “Terapeutic Aspects of Cannabis and Cannabinoids”, in: Br Med J, vol.178, 2001, pp 107-115
-
ROCK EM, LIMEBEER CL, MECHOULAM R, PARKER LA (2009). “Cannabidiol (the non-psychoactive component of cannabis) may act as a 5-HT1A auto-receptor agonist to reduce toxin-induced nausea and vomiting. Proceedings 19th Annual Symposium on the Cannabinoids” International Cannabinoid Research Society: St. Charles, IL, p. 29
-
RODRIGUES GOULART H, KIMURA EA, PERES VJ, COUTO AS, AQUINO DUARTE FA, KATZIN AM (2004). “Terpenes arrest parasite development and inhibit biosynthesis of isoprenoids in Plasmodium falciparum “Antimicrobial Agents Chemother 48: 2502–2509
-
ROSETTI D.V., 1959, Movilele funerare de la Gurbăneşti. (r. Lehliu, reg. Bucureşti), Materiale şi Cercetari Arheologice, vol. 6: 791-816.
-
RUBINSON S. KAREN, 1990, The Textiles from Pazyryk, Expedition, vol. 32(1), pp. 49-61.
-
RUDENKO SERGEI IVANOVICH, 1970, Frozen Tombs of Siberia: the Pazyryk Burials of Iron Age Horsemen, University of California, Berkeley.
-
RUSSO B. ETHAN, 2007, History of Cannabis and its Preparations in Saga, Science, and Sobriquet, Chemistry and Biodiversity, vol. 4, pp. 1614-1648
-
RUSSO EB (2001). “Handbook of Psychotropic Herbs: A Scientific Analysis of Herbal Remedies for Psychiatric Conditions” Haworth Press: Binghamton, NY
-
RUSSO EB, Burnett A, Hall B, Parker KK (2005). “Agonistic properties of cannabidiol at 5-HT-1a receptors” Neurochem Res 30: 1037–1043
-
RUSSO EB, Guy GW (2006). “A tale of two cannabinoids: the therapeutic rationale for combining tetrahydrocannabinol and cannabidiolo” Med Hypotheses 66: 234–246
-
RUSTICHELLI C., GAMBERINI G. E BARALDI M. (1996): Determinazione dei contenuti di cannabinoidi in Cannabis sativa L. mediante cromatografia liquida abbinata alla spettrometria di massa. Sementi Elette, 2: 67-70.
-
SAMUELSON, L.C.; SWANBERG, L.J.; GANTZ, I. “Mapping of the novel G protein-coupled receptor Gpr18 to distal mouse chromosome 14.Mamm” Genome, 1996, 7(12), 920-921
-
SAMORINI GIORGIO, 1996, L’erba di Carlo Erba. Per una storia della canapa indiana in Italia (1845-1948), Nautilus, Torino.
-
SANGUINETTI M, POSTERARO B, ROMANO L, BATTAGLIA F, LOPIZZO T, DE CAROLIS E ET AL. (2007). “In vitro activity of Citrus bergamia (bergamot) oil against clinical isolates of dermatophytes” J Antimicrob Chemother 59: 305–308
-
SCHULTES R.E. (1970): Random thoughts and queries on the botany of Cannabis. In: “The botany and chemistry of Cannabis”. C.R.B. Joyle e S.H. Curry editori. Churchill, London, Pg. 39-48.
-
SCHULTES R.E., KLEIN W.M., PLOWMAN T., LOCKWOOD T.E. (1974): Cannabis: an example of taxonomic neglect. Bot. Mus. Leafl. (Harvard University), 23: 337-367.
-
SEREBRIAKOVA T.I. (1940): V. Fiber Plants Part 1.in Wulff, E.V.(Ed.), Flora of cultivated plants, Moscow..
-
SHARMA G.K. (1975): Altitudinal variation in leaf epidermal pattems of Cannabis sativa. Bullettin of the Torrey Botanical Club, 102: 199-200.
-
SHARMA S.K., Thomas T.G., Prakash A. e Sharma B.R. (2000): Insecticidial properties of Essential oil of Cannabis sativa L. against mosquito larvae. Entomon, 25 (1): 21-24.
-
SHIRAKAWA I., KASINSKI N., PFEFERMAN A. E CARLINI E.A. (1975): Cannabidiol interferes in the effects of delta-9-tetrahidrocannabinol in man. European Journal of Pharmacology, 28: 172-177.
-
SHIRAKAWA I., ZUARDI A.W., FINKELFARB E. E KARNIOL I.G. (1982): Action of cannabidiol on the anxiety and others effects produced by delta-9-tetrahidrocannabinol in normal subjects. Psychopharmacology, 76: 245-250.
-
SHOYAMA Y., YAGI M., NISHIOKA I. E YAMAUCHI T. (1975): Biosynthesis of cannabinoid acids. Phytochemistry, 14: 2189-2192.
-
SINGH P, SHUKLA R, PRAKASH B, KUMAR A, SINGH S, MISHRA PK ET AL. (2010). “Chemical profile, antifungal, antiaflatoxigenic and antioxidant activity of Citrus maxima Burm. and Citrus sinensis (L.) Osbeck essential oils and their cyclic monoterpene, DL-limonene.” Food Chem Toxicol 48: 1734– 1740
-
SIRIKANTARAMAS S, TAURA F, TANAKA Y, ISHIKAWA Y, MORIMOTO S, SHOYAMA Y (2005). “Tetrahydrocannabinolic acid synthase, the enzyme controlling marijuana psychoactivity, is secreted into the storage cavity of the glandular trichomes” Plant Cell Physiol 46: 1578–1582
-
SMALL E. E BECKSTEAD H.D. (1973): Common cannabinoid phenotypes in 350 stocks of Cannabis. Lloydia, 36: 144-165.
-
SMALL E., BECKSTEAD H. E CHAN A. (1975): The evolution of cannabinoid phenotypes in Cannabis. Economic Botany, 29: 219-232.
-
SMALL E. JUI P.Y. E LEFKOVITCH J.P. (1976): A numerical taxonomic analysis of Cannabis with special reference to species delimitation. Systematic Botany, 1: 67-84.
-
SMALL E. E CRONQUIST A. (1976): A practical and natural taxonomy for Cannabis. Taxon, 25: 405.
-
SPERONI E., GRASSI G. E UTAN A. (2003): Antiinflammatory effects of Cannabis sativa L. extracts containing nonpsycoative cannabinoids. Department of Pharmacology, Università di Bologna. Tesi di Laurea Utan A.
-
STATON PC, HATCHER JP, MORRISON AD, WALKER DJ, PARSONS M, BROWN AJ ET al. (2006) “Determining the role of a third cannabinoid receptor, GPR55, in inflammatory and neuropathic pain” 16th ICRS Annual Symposium on the Cannabinoids; 24–28 June 2006; Hungary. ICRS:Hungary. Abstract 149.
-
STELLA, N., SCHWEITZER, P., AND PIOMELLI, D. (1997) “A second endogenous cannabinoid that modulates long-term potentiation” Nature 388, 773–778
-
STOTT CG, GUY GW, WRIGHT S, WHITTLE BA (2005). “The effects of cannabis extracts Tetranabinex and Nabidiolex on human cytochrome P450-mediated metabolism” In: Symposium on the Cannabinoids, June 27. International Cannabinoid Research Association, Clearwater, FL, p. 163
-
SYTNIK V.P. E STELMAH A.F. (1998): The character of inheritance of differences in cannabinoid content in hemp (Cannabis sativa L.). Jounal of the International Hemp Association, 6: 8-9
-
SUARDO P., “Aromatariorum Thesaurus”, impres. Mediolani anno 1496 de XVI feb., per magistrum Leonardum Pecchel.
-
SUGIURA T., KONDO S., SUKAGAWA A., NAKANE S., SHINODA A., ITOH K. E YAMASHITA A. (1995): K. 2-Arachidonoyl-glycerol: a possible endogenous cannabinoid receptor ligand in brain. Biochem. Biophys. Res. Comm., 215: 89-97.
-
SUURKUUS GERT University of Tartu (estonia) Validation of a new GC analytical method for analysi of THC, CBD, CBN.
-
SYTNIK V.P. E STELMAH A.F. (1998): The character of inheritance of differences in cannabinoid content in hemp (Cannabis sativa L.). Jounal of the International Hemp Association, 6: 8-9.
-
T’AO CEN-KANG & KI-LIN WANG, 1972, The relic site of “oath documents” of East Chou, at Houma, Wen-wu, vol. 4, pp. 27, 37, 71. [in cinese]
-
TAIZ L. E ZEIGER E. (1991): “Plant Physiology“. The Benjamin/Cummings Pubblishing Company, Inc., Los Angeles.
-
TAURA F., MORIMOTO S., SHOYAMA Y. E MECHOULAM R. (1995): First direct evidence for the mechanism of delta-1-tetrahydrocannabinolic acid biosynthesis. Journal of the American Chemistry Society, 117: 9766-9767.
-
TAMBE Y, TSUJIUCHI H, HONDA G, IKESHIRO Y, TANAKA S (1996). “Gastric cytoprotection of the non- steroidal anti-inflammatory sesquiterpene, beta-caryophyllene” Planta Med 62: 469–470
-
THOMAS A, STEVENSON LA, WEASE KN, PRICE MR, BAILLIE G, ROSS RA et al. (2005). “Evidence that the plant cannabinoid delta-9-tetrahydrocannabivarin is a cannabinoid CB1 and CB2 antagonist” Br J Pharmacol 146: 917–926
-
TURNER C.E., HADLEY K.W., FETTERMAN P.S., DOOREBONS N.J., QUMBY M.W. E WALLER C. (1973): Consituents of Cannabis sativa L. IV. Stability of cannabinoids in stored plant material. Journal of the Pharmaceutical Sciences, 62: 1601- 1605.
-
TURNER C.E. E HADLEY K.(1973): Constituents of Cannabis sativa L. II. Absence of cannabidiol in an African variant. Journal of the Pharmaceutical Sciences, 62: 251-255.
-
TURNER J.C., HEMPHILL J.K. E MAHLBERG P.J. (1980): Trichomes and cannabinoid content of developing leaves and bracts of Cannabis sativa L. (Cannabaceae). Journal of the American Botany, 67 (10): 1397-1406.
-
TURNER C., HEMPHILL J.K. E MAHLBERG P.G. (1980): Cannabinoid content of individual plant organs from different geographical strains of Cannabis sativa L. (Cannabinaceae). Journal of Natural Products, 43: 112-122.
-
TURNER C.E., EL SOHLY M.A. E BOEREN E.G. (1980): Constituents of Cannabis sativa L., XVII. A rewiew of the natural constituents. Journal of Natural Products, 43: 169-234.
-
TURNER J.C., MAHLBERG P.G., LANYON V.S. E PLESZCZYNSKA J. (1985): A temporal study of cannabinoid composition in continual clones of Cannabis sativa L. (Cannabaceae). Botanical Gazzette,146 (1): 32-38.
-
UNODC (1987) ST/NAR/8 Reccomended methods for testing Cannabis, Manual for use by national narcotics laboratories.
-
UNOCD (1994) Rapid testing methods of drug of abuse.
-
UNODC (2009) Reccomended methods for identification and analysis of syntetic cannabinoids.
-
VALIERI R., 1887, Sulla canapa nostrana e suoi preparati in sostituzione della Cannabis indica, Tipografia dell’Unione, Napoli, 32 pp.
-
VALIERI R., 1888, Sul Gozzo Esoftalmico curato e guarito dalla sola Canapa e suoi preparati, Tipografia dell’Unione, Napoli, 64 pp.
-
VALLE J., VIEIRA J., AUCELIO J. E VALIO I. (1978): Influence of photoperiodism on cannabinoid content of Cannabis sativa L. . UN Bulletin on Narcotics, 30: 67-68.
-
VAN KLINGEREN B. E TEN HAM M. (1976): Antibacterial activity of delta-.9-tetrahydrocannabinol and cannabidiol. Journal of Microbiology and Serology, 42: 9-12.
-
VANHOVE W., ET AL., “Factors determining yield and quality of illicit indoor cannabis (Cannabis spp.) Production”. Forensic Sci. Int. (2011), doi:10.1016/j.forsciint.2011.06.006
-
VAVILOV N.I. E BUKINICH D.D. (1929): Agriculture Afghanistan. The bullettin of applied botany of genetics and plant breeding, 33: 378-382.
-
VERGA A., 1847, Lettera sull’haschisch, Gazzetta Medica di Milano, 10 luglio 1847, :263-264.
-
VERGA A., 1848, Sull’haschisch. Lettera seconda, Gazzetta Medica Lombarda, 2°ser., vol. 1, pp. 303-308.
-
VERGA A., 1848, Sull’haschisch, Annali Universali di Medicina, 127:423-425;
-
VERGA A., 1848, Diversi preparati di haschisch, Gazzetta Medica Lombarda, 2° s., 1:79;
-
VERGA A., 1863, Lipemania guarita coll’haschisch, Gazzetta Medica Italo-Lombarda, 32 (5° s.), 2°:275.
-
VERESS T. (2004): Separazione HPLC dei principali cannabinoidi neutri usando una fase stazionaria a base silicea modificata con polietilene glicole legato chimicamente. The Reporter, 12: 7-8.
-
VIGNOLO G., 1894, Sull’essenza di Cannabis indica, Rendiconti Reale Accademia dei Lincei, 5° s., vol. 3, pp. 404-407.
-
VIGNOLO G., 1895, Sull’essenza di Cannabis indica, Gazzetta Chimica Italiana, vol. 25(I), pp. 110-114.
-
VIGNOLO G. & F. MARINO-ZUCO, 1895, Sopra gli alcaloidi della Cannabis indica e della Cannabis sativa, Rendiconti Reale Accademia dei Lincei, (5° s.), vol. 4, pp. 253-25 -
-
VIGUSHIN DM, POON GK, BODDY A, ENGLISH J, HALBERT GW, PAGONIS C ET al. (1998). “Phase I and pharmacokinetic study of d-limonene in patients with advanced cancer. Cancer Research Campaign Phase I/II Clinical Trials Committee” Cancer Chemother Pharmacol 42: 111–117
-
VIROVETS V.G., STSERBANJ I.I. E SITNIK T.I. (1976): On seed productivity of the monoecious hemp hybrids. Biol. vozd. i pervich. obrobt. kon. i kenafa, Gluchov, 39: 21-26.
-
VOGELMANN A.F., Turner J.C. e Mahlberg P.G. (1988): Cannabinoid composition in seedlings compared to adult plants of Cannabis sativa. Journal of Natural Products, 51: 1075-1079.
-
VOLLNER L, BIENIEK D, KORTE F (1969). “Hashish. XX. Cannabidivarin, a new hashish constituent” Tetrahedron Lett 3: 145–147
-
WALTON, R.P., “Marihuana. America’s New Drug Problem”, Philadelphia, J.B. Lippincott & Co., 1938
-
WATTENBERG LW (1991). “Inhibition of azoxymethane-induced neoplasia of the large bowel by 3- hydroxy-3,7,11-trimethyl-1,6, 10-dodecatriene (nerolidol)” Carcinogen 12: 151–152
-
WESTGAARD, M., 1958. The mechanism of sex determination in dioecious plants. Adv Genet 9: 217– 281
-
WILKINSON JD, WILLIAMSON EM (2007). “Cannabinoids inhibit human keratinocyte proliferation through a non-CB1/CB2 mechanism and have a potential therapeutic value in the treatment of psoriasis” J Dermatol Sci 45: 87–92
-
WILLIAMS SJ, HARTLEY JP, GRAHAM JD (1976). “Bronchodilator effect of delta1-tetrahydrocannabinol administered by aerosol of asthmatic patients” Thorax 31: 720–723
-
WILLIAMSON, E.M., Evans, F.J., “Cannabinoids in Clinical Pratice”, Drugs, vol. 60, 2000, pp. 1303- 1314
-
WILMOT-DEAR C.M. (1999): FSA contributions 14: Cannabaceae. Bothalia, 29: 249-252.
-
WILSON, R. I. AND NICOLL, R. A. (2001) “Endogenous cannabinoids mediate retrograde signaling at hippocampal synapses” Nature 410, 588–592 125
-
WIRTH PW, WATSON ES, ELSOHLY M, TURNER CE, MURPHY JC (1980). “Anti-inflammatory properties of cannabichromene” Life Sci 26: 1991–1995
-
WISE, L.E.; SHELTON, C.C.; CRAVATT, B.F.; MARTIN, B.R.; LICHTMAN, A.H. “Assessment of anandamide's pharmacological effects in mice deficient of both fatty acid amide hydrolase and cannabinoid CB1 receptors” Eur. J. Pharmacol., 2007, 557(1), 44-48
-
WOENIG FRANZ, 1897, Die Pflanzen im Alten Aegypten, Verlag von Albert Heitz, Leipzig.
-
WU Z.Y. & P.H. RAVEN, 2003, Flora of China, 5 voll. Science Press, Beijing
-
YAGEN B. E MECHOULAM R. (1969): Stereospecific cyclizations and isomerizations of cannabichromene and related cannabinoids. Tetrahedron, 60: 5356-5363.
-
YANG D, MICHEL L, CHAUMONT JP, MILLET-CLERC J (1999). “Use of caryophyllene oxide as an antifungal agent in an in vitro experimental model of onychomycosis” Mycopathologia 148: 79–82
-
ZANELATI TV, BIOJONE C, MOREIRA FA, GUIMARAES FS, JOCA SR (2010). “Antidepressant-like effects of cannabidiol in mice: possible involvement of 5-HT1A receptors” Br J Pharmacol 159: 122–128
-
ZHUKOVSKII P.M. (1950): In “Cultivated plants and their wild relatives”. Third edition, Kolos Ed., Leningrad, Pg. 421-422.
-
ZOHARY D. E HOPF M. (1994): In “Domestication of plants in the Old World”. Second edition, Clarendon Press, Oxford, Pg. 126-127.
-
ZLAS JOE, HARLEY STARK, JON SELIGMAN, RINA LEVY & ELLA WERKER, 1993, Early medical use of cannabis, Nature, vol. 363, p. 215.
-
ZUARDI A.W., FINKELFARB E., BUENO O.F.A., MUSTY R.E. E KARNIOL I.G. (1981): Characteristics of the stimulus produced by the mixture of cannabidiol with delta9-tetrahydrocannabinol. Archives Internationales de Pharmacodynamie et de Therapie, 249 (1): 137-146.
-
ZUARDI A.W., SHIRAKAWA I., FINKELFARB E. E KARNIOL I.G. (1982): Action of cannabidiol on the anxiety and others effects produced by delta 9 tetrahidrocannabinol in normal subjects. Psychopharmacology, 76: 245-250.
-
ZUARDI A.W. E KARNIOL I.G. (1983): Changed in the conditionated emotional respons of rats induced by delta9-tetrahidrocannabinol, cannabidiol and mixture of the two cannabinoids. Arquivos de Biologia y Tecnologia, 26: 213-217.
-
ZUMAGLINI A.M.; Flora Paedemontana 1849-1860.
-
ZYGMUNT, P.M.; PETERSSON, J.; ANDERSSON, D.A.; CHUANG, H.; SORGARD, M.; DI MARZO, V.; JULIUS, D.; HOGESTATT, E.D. “Vanilloid receptors on sensory nerves mediate the vasodilator action of anandamide” Nature, 1999, 400(6743), 452-457
24. Iconografia
-
Fig.1: http://antiquecannabisbook.com/images/cannabis_extract_1.jpg Ultima visita 8 marzo 2015;
-
Fig.2: http://pharm1.pharmazie.uni-greifswald.de/allgemei/koehler/koeh-eng.htm List of Koehler Images Copyright expired due to age of image Source: from ''Koehler's Medicinal-Plants'' 1887, Ultima visita 8 marzo 2015;
-
Fig.3: Montagne dell'Himalaya http://upload.wikimedia.org/wikipedia/commons/2/25/CannabisDhaulagiri.JPG Copyright expired. Ultima visita 8 marzo 2015;
-
Fig.4: G.Samorini, Pubblicato: maggio 2, 2013 http://samorini.it/site/wp-content/uploads/2009/11/cannabis-cina-Jang.jpg Ultima visita 8 marzo 2015;
-
Fig.5: G.Samorini, Pubblicato: aprile 18, 2013 Evoluzione dell’ideogramma cinese “ma”, che significa “canapa”. A sinistra il primitivo ideogramma nella scrittura chuan; al centro nella scrittura chieh; a destra nella scrittura hsing (da Li, 1974b, fig. 1, p. 295) http://samorini.it/site/wp-content/uploads/2009/11/arc-canapa-cina2.gif Ultima visita 8 marzo 2015;
-
Fig.6: G.Samorini, Pubblicato: aprile 18, 2013 http://samorini.it/site/wp-content/uploads/2009/11/arc-canapa-cina3.gif Ultima visita 8 marzo 2015;
-
Fig.7: G.Samorini, Pubblicato: aprile 18, 2013. I nomi e i relativi ideogrammi dei genere i delle diverse parti della canapa (da Li, 1974b, fig. 2, p. 296) http://samorini.it/site/archeologia/asia/canapa-antica-cina/#sthash.n7xejtdd.dpuf Ultima visita 8 marzo 2015;
-
Fig.8: G.Samorini, Pubblicato: aprile 18, 2013. http://samorini.it/site/wp-content/uploads/2009/11/arc-canapa-cina1.gif Ultima visita 8 marzo 2015;
-
Fig.9: Dispersione primaria http://4.bp.blogspot.com/-7jU21eGlyJ8/Tf3YKWVWFrI/AAAAAAAADkI/SQwMtgXG638/s1600/image003.jpg Ultima visita 8 marzo 2015;
-
Fig 10: G.Samorini, Pubblicato: maggio 2, 2013 Alcuni dei semi di canapa ritrovati nell’inumazione maschile del kurgan di Pazyryk 2 (da Russo, 2007, fig. 8, p. 1635) http://samorini.it/site/wp-content/uploads/2009/12/cannabis-sciti-semi.jpg Ultima visita 8 marzo 2015;
-
Fig.11: G.Samorini, Pubblicato: aprile 18, 2013, Tripode sopra a un incensiere di rame, uno strumento per l’inalazione dei fumi di canapa. Pazyryk (Altai orientale, 500-300 a.C.) http://samorini.it/site/wp-content/uploads/2009/12/canapa-sciti.jpg Ultima visita 8 marzo 2015;
-
Fig.12: G.Samorini, Pubblicato: aprile 18, 2013 , Braciere di bronzo ritrovato nel kurgan di Pazyryk 2, contenente semi carbonizzati di canapa (da Jettmar, 1981, p. 532) http://samorini.it/site/wp-content/uploads/2009/12/canapa-sciti2.gif Ultima visita 8 marzo 2015;
-
Fig.13: G. Samorini Pubblicato: aprile 23 2013.Camicia ritrovata nell’inumazione di Pazyryk 2, costituita di canapa e kendyr (da Charrière, 1979, fig. 320, rip. in Rubinson, 1990, p. 51, fig. 4)http://samorini.it/site/wp-content/uploads/2009/12/canapa-sciti3.jpg Ultima visita 8 marzo 2015;
-
Fig.14: Geroglifico egiziano che sembrerebbe indicare la pianta della canapa (da Dawson, 1934, p. 44) - http://samorini.it/site/archeologia/africa/droghe-antichi-egiziani/canapa-egitto/#sthash.YTCtazr9.jpg Ultima visita 8 marzo 2015;
-
Fig.15: Papiro Ramesseum III (British Museum London) http://www.britishmuseum.org/images/Respro_ramesseum_624a.jpg Ultima visita 8 marzo 2015;
-
Fig.16: Papiro di Ebers Fogli VI e VII (Rare Book Room, New York Academy of Medicine) http://upload.wikimedia.org/wikipedia/commons/thumb/5/51/EdSmPaPlateVIandVIIPrintsx.jpg/310px-EdSmPaPlateVIandVIIPrintsx.jpg Ultima visita 8 marzo 2015;
-
Fig.17: Papiro Chester Beatty, (Chester Beatty Library, Dublin, Ireland) http://upload.wikimedia.org/wikipedia/commons/thumb/d/da/P._Chester_Beatty_I%2C_folio_13-14%2C_recto.jpg/310px-P._Chester_Beatty_I%2C_folio_13-14%2C_recto.jpg Ultima visita 8 marzo 2015;
-
Fig.18: La prima e più famosa tavoletta medica Assira in cui compare la parola Canapa (British Museum of London ) http://upload.wikimedia.org/wikipedia/commons/thumb/c/ca/Cuneiform_script2.jpg/180px-Cuneiform_script2.jpg Ultima visita 8 marzo 2015;
-
Fig.19: G.Samorini Pubblicato maggio 2, 2013 “Uomo di Yingpan”, mummia del III secolo d.C. ritrovata nel bacino di Tarim, Cina occidentale. La maschera è fatta di canapa e gesso (da Knauer, 1999, fig. 27, p. 1179) http://samorini.it/site/wp-content/uploads/2009/11/cannabis-cina-uomo-yingpan.jpg Ultima visita 8 marzo 2015;
-
Fig.20: Oceanic trasport of cannabis by African immigrants 1750 – 1940. Copyright free.
-
Fig.21: W. S. O’Shaughnessy http://upload.wikimedia.org/wikipedia/commons/a/a5/William_Brooke_O%E2%80%99Shaughnessy_1.jpg Ultima visita 8 marzo 2015;
-
Fig.22: Dr. W. B. O'Shaughnessy (courtesy of the National Library of Medicine] http://antiquecannabisbook.com/chap1/OShaughnessy.jpg Ultima visita 8 marzo 2015;
-
Fig.23: Ritratto del Dott. Giovanni Polli Museo Galileo - Istituto e Museo di Storia della Scienza. http://mostre.museogalileo.it/images/csi/personaggi_944/999200_00019z_944.jpg Ultima visita 8 marzo 2015;
-
Fig.24:Il farmacista Carlo Erba. L'Erba di Carlo Erba - Edizioni Nautilus http://upload.wikimedia.org/wikipedia/commons/0/0e/Carlo_Erba.png Ultima visita 8 marzo 2015;
-
Fig.25: Cannabis sativa L. ''Koehler's Medicinal-Plants'' 1887 http://www.unodc.org/images/odccp/bulletin/bulletin_1950-01-01_4_page003_img001_large.gif Ultima visita 8 marzo 2015;
-
Fig.26: Cannabis indica, sativa, ruderalis. http://cdn1.theweedblog.com/wp-content/uploads//cannabis-varieties.png Ultima visita 8 marzo 2015;
-
Fig.27: Schema riportante le aree di classificazione delle piante in base al contenuto in cannabinoidi
-
Fig.28: Stadio germinazione del seme http://4.bp.blogspot.com/-YEwOZFUijWE/Tf3YeZlkr7I/AAAAAAAADkQ/IdKDPaj4SLA/s640/image007.jpg Ultima visita 8 marzo 2015;
-
Fig.29: Prime fasi vegetative http://4.bp.blogspot.com/-dEbD_WfEIso/Tf3YrI9S4JI/AAAAAAAADkU/2_dFzZa1Y4Q/s640/image009.jpg Ultima visita 8 marzo 2015;
-
Fig.30 e Fig.31: Fiori maschili e femminili http://1.bp.blogspot.com/-XTuu2scVRw0/Tf3Y5Ui_4RI/AAAAAAAADkc/iX-OBiZv5Xg/s320/image013.jpg
http://2.bp.blogspot.com/-s56_d5X1aW4/Tf3YzWQWpVI/AAAAAAAADkY/05aW6k1kgMU/s320/image011.jpg Ultima visita 8 marzo 2015;
-
Fig.32:Variabilità delle misure biometriche del seme http://www.erbavoglio.it/dati/DynChange/upload/img_news/grande_cannabis_seeds.jpg Ultima visita 8 marzo 2015;
-
Fig.33: Infiorescenza di una pianta monoica H. Zell - Opera propria, Creato: 5 agosto 2009 http://upload.wikimedia.org/wikipedia/commons/thumb/d/db/Cannabis_sativa_001.JPG/640px-Cannabis_sativa_001.JPG Ultima visita 8 marzo 2015;
-
Fig.34: Fasi di sviluppo del fiore femminile non impollinato http://1.bp.blogspot.com/-UPQ1Toohm2g/Tf3dYU_4C-I/AAAAAAAADko/FDdz3URdUAI/s1600/image019.jpg Ultima visita 8 marzo 2015;
-
Fig.35: Sintesi dei Cannabinoidi (da Fellermeier e Zenk, 1998) https://encrypted-tbn3.gstatic.com/imagesq=tbn:ANd9GcTsC2JhRZLknbgvpyEQVp_4MhEDQWaqygb3V3e93FqYL80pCWI9 Ultima visita 8 marzo 2015;
-
Fig.36: Regolazione genetica della sintesi dei Cannabinoidi (De Meijer GW Pharm.) http://www.gwpharm.com/uploads/chemovars%5B0%5D.jpg Ultima visita 8 marzo 2015;
-
Fig.37: Tricomi ghiandolari su foglia http://1.bp.blogspot.com/-BUAxTzJeux4/Tf3dfKw-Y9I/AAAAAAAADks/69FHUHhi3D8/s1600/image021.jpg Ultima visita 8 marzo 2015;
-
Fig.38: Tricoma ghiandolare (Briosi e Tognini, Pavia, 1894) http://www.hempology.ca/textbook/lectures/lesson6.jpg Ultima visita 8 marzo 2015;
-
Fig.39 e Fig.40: Tricomi di Cannabis sativa L. sul fiore e sulle foglie. William Cole Ektor http://images.fineartamerica.com/images-medium-large/purple-trichomes-william-cole-ektor.jpg http://www.rollingstoned.nl/wp-content/uploads/2014/06/Querkle-Trichomes-Closeup.jpg Ultima visita 8 marzo 2015;
-
Fig.41: Tricomi di Cannabis sativa L. http://upload.wikimedia.org/wikipedia/commons/e/e8/Trichomes_Close_Cannabis.jpg Ultima visita 8 marzo 2015;
-
Fig.42: Tricoma sessile (al centro) SciencePhoto Library http://www.sciencephoto.com/image/571059/350wm/C0195324-Cannabis_trichomes,_light_micrograph-SPL.jpg Ultima visita 8 marzo 2015;
-
Fig.43 e Fig.44: Tricomi bulbosi Science Photo Library http://www.sciencephoto.com/image/571058/350wm/C0195323-Cannabis_trichomes,_light_micrograph-SPL.jpg Ultima visita 8 marzo 2015;
-
Fig.45: Siti di biosintesi e bioaccumulo dei cannabinoidi (da Mahlberg e Kim, 2003) http://4.bp.blogspot.com/-N3Dw4zPosoU/Tf3d3Gn_hJI/AAAAAAAADk0/7CM9WBnzYgY/s640/image024.jpg Ultima visita 8 marzo 2015;
-
Fig.46: Classificazione degli aromi attribuibili ai terpeni http://www.alchimiaweb.com/blogen/wp-content/uploads/2014/06/FlavourPie_strain_english_2012.png Ultima visita 8 marzo 2015;
-
Fig.47: Tabella dei terpeni struttura, attività farmacologica e cannabinoidi sinergici http://www.elitecannabis.com/wp-content/uploads/2014/06/terpenes.gif Ultima visita 8 marzo 2015;
-
Fig.48: Biosintesi dei principali cannabinoidi naturali (da Mechoulam e Ben-Shabat 1999) http://3.bp.blogspot.com/-rBjmKiJHupQ/Tf3eIFGPCcI/AAAAAAAADk4/oDv5QzVhAak/s1600/image026.jpg Ultima visita 8 marzo 2015;
-
Fig.49: Formule di struttura dei principali cannabinoidi http://3.bp.blogspot.com/-z9AdB8xRD0I/Tf3eV84khyI/AAAAAAAADlA/1uNlVP0cTqY/s640/image030.jpg
-
Fig.50 e fig.51: Endocannabinoidi Di Marzo, Petroccellis http://2.bp.blogspot.com/-FeN7S3j-Wuw/Tf3efjq6mII/AAAAAAAADlE/d0L2H-64HKQ/s640/image032.jpg
http://www.medicalcannabis.it/ananda.gif Ultima visita 8 marzo 2015;
-
Fig.51: Sito di azione dei recettori cannabinoidi http://images.treccani.it/enc/media/share/images/orig//system/galleries/la_mente/endocannabinoidi_fig_vol1_003970_002.jpg Ultima visita 8 marzo 2015;
-
Fig.52: Recettore CB1 e 2 http://upload.wikimedia.org/wikipedia/commons/thumb/c/c8/Cb1_cb2_structure.png/220px-Cb1_cb2_structure.png Ultima visita 8 marzo 2015;
-
Fig.53: Cascata d'attivazione Recettori CB http://www.cancer-therapy.org/CT/v6/A/HTML/11._Fogli_&_Breschi,_103-116_files/image004.gif
-
Fig.54: Recettori GPR http://www.leafscience.com/wp-content/uploads/2014/07/cannabis-cures-study-07-141-720x340.jpg
-
Fig.55: Recettore TRPV1http://www.liquidarea.com/wp-content/uploads/2009/07/TRPV1.jpg
-
Fig.56 Cannabinoidi sintetici http://www.degruyter.com/view/j/labm.2013.37.issue-4/labmed-2012-0059/graphic/labmed-2012-0059_fig1.jpg
-
Fig.57: Bedrocan flos http://www.voc-nederland.org/wp-content/uloads//Bedrocan_mediwiet1.gif Ultima visita 8 marzo 2015;
-
Fig.58: Ricettario fiorentino, 1498 Antonio Corvo http://www.storiadellafarmacia.it/wp-content/uploads/2011/08/Ricettario-Fiorentino-185x300.jpg Ultima visita 8 marzo 2015;
-
Fig.59 :Farmacopea Universale del Lemery 1742 Museo Aboca http://www.abocamuseum.it/Media/foto_libri/15Lemery%5C15_frontespizio.jpg Ultima visita 8 marzo 2015;
-
Fig.60: L.V. Brugnatelli (1761-1818) Antonio Corvo http://www.storiadellafarmacia.it/wp-content/uploads/2011/08/L.V.-Brugnatelli-1761-1818-300x284.jpg Ultima visita 8 marzo 2015;
-
Fig.61: La “Farmacopea Ferrarese”, Bologna Cardinali e Freulli 1826 (12a ed.) http://www.belriguardo.it/imgs/tpg8k8i98ajakb2u.jpg Ultima visita 8 marzo 2015;
-
Fig.62: FarmacopeaUfficiale del regno d'Italia (University of Toronto) https://covers.openlibrary.org/b/id/6499659-M.jpg Ultima visita 8 marzo 2015;
-
Fig.63: Farmacopea dell'Orosi (1851) http://www.maremagnum.com/uploads/item_image/image/58/thumb_farmacologia-teorica-pratica-farmacopea-italiana-ba0c018e-1a81-4f63-a8ad-9c7edba9877f.jpg Ultima visita 8 marzo 2015;
-
Fig.64 e Fig.65: US Pharmacopoeia 1851(Lane Medical Library, San Francisco) http://antiquecannabisbook.com/images/USP1900_A.jpg Ultima visita 8 marzo 2015;
-
Fig.66, Fig.67 e Fig.68: Estratti farmaceutici statuinitensi http://antiquecannabisbook.com/images/LillyA.jpg http://antiquecannabisbook.com/images/HKMulford_A.jpg http://antiquecannabisbook.com/images/ParkeDavisC.jpg Ultima visita 8 marzo 2015;
-
Fig.70: American Herbal Pharmacopoieia Monograph http://www.herbal-ahp.org/images/mono_covers/sm-cannabisqcrevision2014.jpg Ultima visita 8 marzo 2015;
-
Fig.71, 72, 73, 74: Farmacopea Ufficiale, 1909 (University of Toronto) http://thumbs.ebaystatic.com/d/l225/m/miHfX-H-pVOiJnVK1smVJrA.jpg Ultima visita 8 marzo 2015;
-
Fig.75: Indian Cigarettes by Grimault http://antiquecannabisbook.com/images/C03CCigarigoIndio.jpg 7 marzo 2015
-
Fig.76-84: Fasi di coltivazione, raccolta seccaggio, Quality Control presso l'azienda Bedrocan BV, NL. www.bedrocan.nl Ultima visita 8 marzo 2015;
-
Fig.85: Canabis Protectio. Iscrizione di una volta di Bologna in Via dell’Indipendenza, 1400 circa. http://farm3.staticflickr.com/2616/3689919940_4037940c30.jpg Ultima visita 8 marzo 2015.